
Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Difterijas cēloņi un patoģenēze
Raksta medicīnas eksperts
Pēdējā pārskatīšana: 04.07.2025
Difterija ir toksigēnu infekcijas slimību paradigma. 1883. gadā Klebs pierādīja, ka difterijas izraisītājs ir Corynebacterium diphtheriae. Gadu vēlāk Leflers atklāja, ka organismu var kultivēt tikai no nazofaringālas dobuma, un ierosināja, ka iekšējo orgānu bojājumus izraisa šķīstošs toksīns. Līdz 1888. gadam Rū un Jersins pierādīja, ka dzīvniekiem, kuriem injicēja sterilus C. diphtheriae filtrātus, attīstījās orgānu patoloģija, kas neatšķiras no cilvēka difterijas patoloģijas; tas parādīja, ka galvenais virulences faktors ir spēcīgs eksotoksīns.
Difterija visbiežāk ir augšējo elpceļu infekcija, kas izraisa drudzi, iekaisis kakls un nespēku. Bieza, pelēkzaļa fibrīna membrāna jeb pseidomembrāna bieži veidojas infekcijas vietā(-ās) baktēriju augšanas, toksīna veidošanās, pamatā esošās audu nekrozes un saimnieka imūnās atbildes kombinētās ietekmes rezultātā. Atziņa, ka sistēmiski orgānu bojājumi rodas difterijas toksīna darbības rezultātā, ir novedusi pie gan efektīvas uz antitoksīnu balstītas terapijas izstrādes akūtas infekcijas ārstēšanai, gan pie ļoti efektīvas toksoīda vakcīnas izstrādes.
Lai gan toksoīdu imunizācija ir padarījusi difteriju par retu slimību apgabalos, kur sabiedrības veselības standarti pieprasa vakcināciju, difterijas uzliesmojumi joprojām notiek neimunizētās un imūndeficīta grupās. Turpretī plaši izplatīti difterijas uzliesmojumi, kas sasniedz epidēmijas apmērus, ir notikuši apgabalos, kur aktīvās imunizācijas programmas ir apturētas.
Citi korinebaktēriju veidi
Papildus C. diphtheriae, C. ulcerans un C. pseudotuberculosis, arī C. pseudodiphtheriticum un C. xerosis reizēm var izraisīt nazofaringālas un ādas infekcijas. Pēdējos divus celmus var atpazīt pēc spējas producēt pirazinamidāzi. Veterinārmedicīnā C. renale un C. kutscheri ir nozīmīgi patogēni, kas attiecīgi izraisa pielonefrītu liellopiem un latentas infekcijas pelēm.
Cēloņi
Difterijas izraisītājs Corynebacterium diphtheriae ir plāns, nedaudz izliekts stienis ar nūjas formas sabiezējumiem galos, nekustīgs; tas neveido sporas, kapsulas vai flagellas un ir grampozitīvs.
Papildus toksīnam difterijas korinebaktērijas savu dzīvības procesu laikā ražo neiraminidāzi, hialuronidāzi, hemolizīnu, nekrotizējošus un difūzus faktorus, kas var izraisīt saistaudu galvenās vielas nekrozi un sašķidrināšanos.
Pamatojoties uz spēju veidot toksīnu, difterijas korinebaktērijas tiek iedalītas toksigēnās un netoksīgēnās.
Difterijas toksīns ir spēcīgs bakteriāls eksotoksīns, kas nosaka gan vispārējās, gan lokālās slimības klīniskās izpausmes. Toksigenitāte ir ģenētiski noteikta. Difterijas netoksigēnās korinebaktērijas slimību neizraisa.
Pēc kultūras un morfoloģiskajām pazīmēm visas difterijas korinebaktērijas iedala 3 variantos: gravis, mitis un intermedius. Slimības smagums nav tieši atkarīgs no difterijas korinebaktēriju varianta. Katrā variantā ir gan toksigēni, gan netoksigēni celmi. Visu variantu toksigēnās korinebaktērijas ražo identisku toksīnu. [ 1 ]
Struktūra, klasifikācija un antigēnu veidi
Corynebacterium diphtheriae ir grampozitīva, nekustīga, vālītes formas baktērija. Celmiem, kas aug audos vai vecākās in vitro kultūrās, šūnu sieniņās ir smalki plankumi, kas ļauj tām atkrāsoties Grama krāsošanas laikā un rada mainīgu Grama reakciju. Vecākās kultūrās bieži ir metahromatiskas granulas (polimetafosfāts), kas iekrāsojas zilgani violetā krāsā ar metilēnzilo krāsu. Šūnu sieniņu cukuri ietver arabinozi, galaktozi un mannozi. Turklāt var izolēt toksisko trehalozes 6,6'-esteri, kas satur korinimikolskābi un korinimikolēnskābi ekvimolārās koncentrācijās. Ir atzīti trīs atšķirīgi kultūru veidi: mitis, intermedius un gravis.
Lielākajai daļai celmu augšanai nepieciešamas nikotīnskābes un pantotēnskābes; dažām nepieciešams arī tiamīns, biotīns vai pimelīnskābe. Lai nodrošinātu optimālu difterijas toksīna ražošanu, barotne ir jāpapildina ar aminoskābēm un jānoliek malā.
Jau 1887. gadā Leflers aprakstīja avirulentu (netoksigēnu) C. diphtheriae izolēšanu, kurus nevarēja atšķirt no virulentiem (toksigēniem) celmiem, kas izolēti no pacientiem, veseliem indivīdiem. Tagad ir atzīts, ka avirulentus C. diphtheriae celmus var pārvērst virulentā fenotipā pēc inficēšanās un lizogenizācijas ar vienu no vairākiem atšķirīgiem korinebakteriofāgiem, kas nes difterijas toksīna strukturālo gēnu tox. Avirulenta lizogēnā pārveidošanās par virulentu fenotipu var notikt gan in situ, gan in vitro. Difterijas toksīna strukturālais gēns nav būtisks ne korinebakteriofāgam, ne C. diphtheriae. Neskatoties uz šo novērojumu, difterijas toksīna ģenētiskā novirze nav novērota.
Pathogenesis
Infekcijas iekļūšanas punkti ir orofarinksa, deguna, balsenes gļotāda, retāk acu un dzimumorgānu gļotāda, kā arī bojāta āda, brūču vai apdegumu virsmas, autiņbiksīšu izsitumi, nedzīstoša nabas brūce. Iekļūšanas punktā vairojas difterijas korinebaktērija un izdala eksotoksīnu.
Epitēlija šūnu nekrozes laikā izdalītās trombokināzes ietekmē izdalās eksudāts, kas bagāts ar fibrinogēnu, un tas pārvēršas fibrīnā. Veidojas fibrīna plēvīte – raksturīga difterijas pazīme.
Asimptomātiska nazofaringāla nēsāšana ir bieži sastopama difterijas endēmiskajos reģionos. Jutīgiem indivīdiem toksigēni celmi izraisa slimību, replicējot un sekretējot difterijas toksīnu nazofarneksā vai ādas bojājumos. Difterijas bojājumu bieži klāj pseidomembrāna, kas sastāv no fibrīna, baktērijām un iekaisuma šūnām. Difterijas toksīnu var proteolītiski sadalīt divos fragmentos: N-terminālajā fragmentā A (katalītiskajā domēnā) un fragmentā B (transmembrānas un receptoru saistošajos domēnos). Fragments A katalizē elongācijas faktora 2 NAD+ atkarīgo ADP-ribozilēšanu, tādējādi kavējot olbaltumvielu sintēzi eikariotu šūnās. Fragments B saistās ar šūnas virsmas receptoru un atvieglo fragmenta A piegādi citozolam.
Aizsargājošā imunitāte ietver antivielu reakciju uz difterijas toksīnu pēc klīniskas slimības vai pret difterijas toksīnu (toksīnu, ko inaktivē formaldehīds) pēc imunizācijas.
Kolonizācija
Maz ir zināms par faktoriem, kas veicina C. diphtheriae kolonizāciju. Tomēr ir skaidrs, ka virulenci veicina arī citi faktori, ne tikai difterijas toksīna ražošana. Epidemioloģiskie pētījumi liecina, ka noteikts lizotips var saglabāties populācijā ilgu laiku. Vēlāk to var aizstāt ar citu lizotipu. Jauna lizotipa parādīšanās un sekojošā dominance populācijā, domājams, ir saistīta ar tā spēju kolonizēties un efektīvi konkurēt savā nazofaringālās ekoloģiskās nišas segmentā. Corynebacterium diphtheriae var ražot neiraminidāzi, kas sašķeļ šūnas virsmas siālskābi tās sastāvdaļās - piruvātā un N-acetilneiramīnskābē. Naglas faktors (6,6'-di-O-mikoloil-α, α'-D-trehaloze) ir C. diphtheriae virsmas komponents, taču tā loma cilvēka saimnieka kolonizācijā nav skaidra.
Difterijas toksīnu ražošana
Difterijas toksīna strukturālais gēns tox pieder pie cieši radniecīgu korinebakteriofāgu dzimtas, no kurām vislabāk pētītais ir β-fāgs. Difterijas toksīna ekspresijas regulāciju mediē dzelzs aktivēts represors DtxR, ko kodē C. diphtheriae genoms. Toksīna ekspresija ir atkarīga no C. diphtheriae fizioloģiskā stāvokļa. Apstākļos, kad dzelzs kļūst par augšanas ātrumu ierobežojošo substrātu, dzelzs disociējas no DtxR, toksikodendrona gēns tiek aktivizēts, un difterijas toksīns tiek sintezēts un maksimālā ātrumā izdalīts barotnē.
Difterijas toksīns ir neparasti spēcīgs; jutīgām sugām (piemēram, cilvēkiem, pērtiķiem, trušiem, jūrascūciņām) letāla ir pat 100 līdz 150 ng/kg ķermeņa masas deva. Difterijas toksīns sastāv no vienas polipeptīdu ķēdes, kas sastāv no 535 aminoskābēm. Bioķīmiskā, ģenētiskā un rentgenstaru strukturālā analīze liecina, ka toksīns sastāv no trim strukturāliem/funkcionāliem domēniem:
- N-terminālā ADP-riboziltransferāze (katalītiskais domēns);
- reģions, kas atvieglo katalītiskā domēna piegādi caur šūnas membrānu (transmembrānas domēns);
- eikariotu šūnu receptoru saistošais domēns.
Pēc vieglas tripsīna sagremošanas un reducēšanas denaturējošos apstākļos difterijas toksīnu var specifiski sašķelt tā proteāzes jutīgajā cilpā divos polipeptīdu fragmentos (A un B). A fragments ir toksīna N-terminālais 21 kDa komponents un satur katalītisko vietu elongācijas faktora 2 (EF-2) ADP-ribozilēšanai.
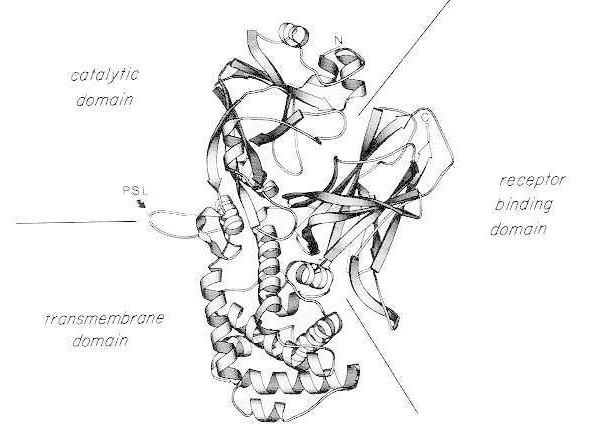
Monomēriskā dabiskā difterijas toksīna rentgenstaru kristāla struktūras lentes diagramma. (modificēta no Bennett MJ, Choe S, Eisenberg D: Domēnu maiņa: sapinšanās starp proteīniem. Proc Natl Acad Sci, USA, 91: 3127, 1994). Attēlotas katalītiskā, transmembrānas un receptoru saistošo domēnu relatīvās pozīcijas. Neskartu toksīnu var šķelt ar tripsīnam līdzīgām proteāzēm Arg190, Arg192 un/vai Arg193, kas atrodas proteāzes jutīgajā cilpā (PSL). Pēc disulfīda tilta reducēšanas starp Cys186 un Cys201 toksīnu var sadalīt A un B fragmentos. Attēlotas neskartā toksīna aminogals (N) un karboksigals (C). Lentes diagramma tika izveidota, izmantojot MOLESCRIPT programmu.
C-terminālais fragments, fragments B, satur toksīna transmembrānas un receptoru saistošos domēnus.
Vienas eikariotu šūnas saindēšana ar difterijas toksīnu ietver vismaz četrus atšķirīgus soļus:
- toksīna saistīšanās ar tā receptoru uz šūnas virsmas;
- lādētu receptoru klasterizācija pārklātās bedrēs un toksīna internalizācija, izmantojot receptoru mediētu endocitozi; pēc endocītiskās pūslīša paskābināšanas ar membrānai piesaistītu, ATP vadītu protonu sūkni,
- transmembrānas domēna ievietošana membrānā un katalītiskā domēna ievadīšanas veicināšana citozolā, un
- EF-2 ADP-ribozilēšana, kā rezultātā tiek neatgriezeniski nomākta olbaltumvielu sintēze.
Ir pierādīts, ka viena katalītiskā domēna molekula, kas piegādāta citozolā, ir pietiekama, lai būtu letāla šūnai.
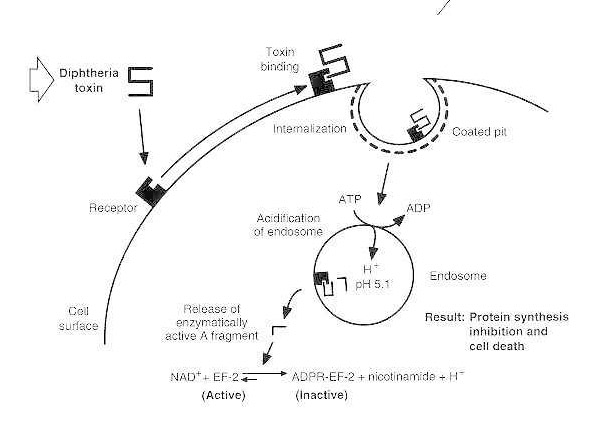
Difterijas intoksikācijas shematiska diagramma uzņēmīgām eikariotu šūnām.
Toksīns saistās ar savu šūnas virsmas receptoru un tiek internalizēts, izmantojot receptoru mediētu endocitozi; pēc endosomas paskābināšanas transmembrānas domēns tiek ievietots pūslīša membrānā; katalītiskais domēns tiek nogādāts citozolā, izraisot olbaltumvielu sintēzes inhibīciju un šūnu nāvi.
Epidemioloģija
Pirms ASV iedzīvotāju masveida imunizācijas ar difterijas toksoīdu difterija parasti bija bērnu slimība. Ievērojams masveida imunizācijas ar difterijas toksoīdu aspekts ir tas, ka, palielinoties iedzīvotāju skaitam ar aizsargājošu antitoksīna imunitātes līmeni (≥ 0,01 SV/ml), toksīno celmu izolēšanas biežums no iedzīvotājiem samazinās. Mūsdienās Amerikas Savienotajās Valstīs, kur klīniskā difterija ir gandrīz pilnībā izzudusi, toksīno C. diphtheriae celmu izolēšana ir reta. Tā kā subklīniskā infekcija vairs nenodrošina iedarbību uz difterijas antigēnu un, ja vien netiek pastiprināta, imunitāte pret antitoksīnu mazinās, lielai daļai pieaugušo (30 līdz 60%) antitoksīna līmenis ir zem aizsargājošā līmeņa, un viņi ir pakļauti riskam. Amerikas Savienotajās Valstīs, Eiropā un Austrumeiropā nesenie difterijas uzliesmojumi galvenokārt ir notikuši starp personām, kuras ļaunprātīgi lieto alkoholu un/vai narkotikas. Šajā grupā toksīno C. diphtheriae nesējiem ir mēreni augsts antitoksiskās imunitātes līmenis. Nesenā sabiedrības veselības pasākumu neveiksme Krievijā ir novedusi pie tā, ka difterija ir kļuvusi par epidēmiju. Līdz 1994. gada beigām Krievijā bija ziņots par vairāk nekā 80 000 saslimšanas gadījumiem un vairāk nekā 2000 nāves gadījumiem.
Difterijas fokālie uzliesmojumi gandrīz vienmēr ir saistīti ar imūnsistēmas nesēju, kurš ir atgriezies no reģiona, kurā difterija ir endēmiska. Patiešām, nesenie klīniskās difterijas uzliesmojumi Amerikas Savienotajās Valstīs un Eiropā ir saistīti ar ceļotājiem, kas atgriežas no Krievijas un Austrumeiropas. Toksigēnie C. diphtheriae celmi tiek pārnesti tieši no cilvēka uz cilvēku ar gaisā esošām pilieniņām. Ir zināms, ka toksigēnie celmi var tieši kolonizēt nazofaringālo dobumu. Turklāt toksigēno gēnu var izplatīt netieši, atbrīvojot toksigēno korinebakteriofāgu un lizogēnu transformāciju netoksigēnajos autohtonos C. diphtheriae in situ. [ 5 ]
Papildus C. diphtheriae izolātu biotipa un lizotipa noteikšanai, molekulārās bioloģijas metodes tagad var izmantot difterijas uzliesmojumu pētīšanai. Klīnisko uzliesmojumu pētīšanai ir izmantoti C. diphtheriae hromosomu DNS restrikcijas endonukleāzes gremošanas modeļi, kā arī klonētu korinebaktēriju ievietošanas secību izmantošana kā ģenētiska zonde.
Šika tests jau daudzus gadus tiek izmantots, lai novērtētu imunitāti pret difterijas toksīnu, lai gan tagad daudzviet to ir aizstājis ar seroloģisko testu specifisku antivielu noteikšanai pret difterijas toksīnu. Šika testā nelielu daudzumu difterijas toksīna (aptuveni 0,8 ng 0,2 ml) injicē intradermāli apakšdelmā (testa vietā), un 0,0124 μg difterijas toksīna 0,2 ml injicē intradermāli kontroles vietā. Rādījumus ņem pēc 48 un 96 stundām. Nespecifiskas ādas reakcijas parasti sasniedz maksimumu pēc 48 stundām. Pēc 96 stundām eritēmatoza reakcija ar iespējamu nekrozi testa vietā norāda uz nepietiekamu antitoksisko imunitāti, lai neitralizētu toksīnu (≤ 0,03 SV/ml). Iekaisums gan testa, gan kontroles zonā pēc 48 stundām norāda uz paaugstinātas jutības reakciju pret antigēna preparātu.
Veidlapas
Corynebacterium diphtheriae inficē nazofarneksu vai ādu. Toksigēnie celmi ražo spēcīgu eksotoksīnu, kas var izraisīt difteriju. Difterijas simptomi ir faringīts, drudzis un kakla vai ap ādas bojājumu esošās zonas pietūkums. Difterijas bojājumus klāj pseidomembrāna. Toksīns izplatās caur asinsriti uz attāliem orgāniem un var izraisīt paralīzi un sastrēguma sirds mazspēju. [ 6 ]
Pastāv divu veidu klīniskā difterija: nazofaringāla un ādas difterija. Faringālās difterijas simptomi var būt no viegla faringīta līdz hipoksijai, ko izraisa elpceļu nosprostojums ar pseidomembranu. Kakla limfmezglu iesaistīšanās var izraisīt smagu kakla pietūkumu (vērša kakla difterija), un pacientam var attīstīties drudzis (≥ 38°C). Ādas bojājumi ādas difterijas gadījumā parasti ir pārklāti ar pelēkbrūnu pseidomembranu. Difterijas toksīna iedarbības rezultātā uz perifērajiem motorajiem neironiem un miokardu var attīstīties dzīvībai bīstamas sistēmiskas komplikācijas, galvenokārt motorisko funkciju zudums (piemēram, apgrūtināta rīšana) un sastrēguma sirds mazspēja.
Kontrole
Difterijas kontrole ir atkarīga no atbilstošas imunizācijas ar difterijas toksoīdu: difterijas toksīnu, kas inaktivēts ar formaldehīdu un paliek antigēniski neskarts. Toksoīdu sagatavo, inkubējot difterijas toksīnu ar formaldehīdu 37°C temperatūrā sārmainā vidē. Imunizācija pret difteriju jāsāk dzīves otrajā mēnesī ar trīs primāro devu sēriju ar 4 līdz 8 nedēļu intervālu, kam seko ceturtā deva aptuveni 1 gadu pēc pēdējās primārās devas. Difterijas toksoīdu plaši izmanto kā difterijas-garā klepus-stingumkrampju (DPT) vakcīnas sastāvdaļu. Epidemioloģiskie pētījumi liecina, ka imunizācija pret difteriju ir aptuveni 97% efektīva. Lai gan Amerikas Savienotajās Valstīs un Eiropā tiek praktizēta masveida imunizācija pret difteriju un bērnu imunizācijas rādītāji ir atbilstoši, lielai daļai pieaugušo iedzīvotāju antivielu titri var būt zem aizsargājošā līmeņa. Pieaugušajiem jāveic revakciācija ar difterijas toksoīdu ik pēc 10 gadiem. Patiešām, ceļotājiem uz apgabaliem ar augstu endēmiskās difterijas līmeni (Centrālā un Dienvidamerika, Āfrika, Āzija, Krievija un Austrumeiropa) jāveic revakcinācija ar difterijas-stingumkrampju toksoīdu. Pēdējos gados ļoti attīrītu toksoīdu preparātu lietošana imunizācijai ir mazinājusi neregulāri smagas paaugstinātas jutības reakcijas. Revakcinācija ar difterijas-stingumkrampju toksoīdu jāveic ceļotājiem uz apgabaliem ar augstu endēmiskās difterijas līmeni (Centrālā un Dienvidamerika, Āfrika, Āzija, Krievija un Austrumeiropa). Pēdējos gados ļoti attīrītu toksoīdu preparātu lietošana imunizācijai ir mazinājusi neregulāri smagas paaugstinātas jutības reakcijas. Revakcinācija ar difterijas-stingumkrampju toksoīdu jāveic ceļotājiem uz apgabaliem ar augstu endēmiskās difterijas līmeni (Centrālā un Dienvidamerika, Āfrika, Āzija, Krievija un Austrumeiropa). Pēdējos gados ļoti attīrītu toksoīdu preparātu lietošana imunizācijai ir mazinājusi neregulāri smagas paaugstinātas jutības reakcijas.
Lai gan antibiotikas (piemēram, penicilīns un eritromicīns) tiek izmantotas kā daļa no difterijas pacientu ārstēšanas, ātra pasīva imunizācija ar difterijas antitoksīnu ir visefektīvākā, lai samazinātu mirstību. Specifiskā antitoksīna ilgais pussabrukšanas periods asinsritē ir svarīgs faktors, lai nodrošinātu efektīvu difterijas toksīna neitralizāciju; tomēr, lai antitoksīns būtu efektīvs, tam ir jāreaģē ar toksīnu, pirms tas var iekļūt šūnā.
Difterijas toksīna pārveidošana eikariotu receptoriem specifisku citotoksīnu izstrādei
Olbaltumvielu inženierija ir jauna un strauji attīstoša joma molekulārajā bioloģijā; tā apvieno rekombinantās DNS metodoloģijas un cietfāzes DNS sintēzi, lai izstrādātu un konstruētu himēriskus gēnus, kuru produktiem piemīt unikālas īpašības. Difterijas toksīna struktūras un funkcijas attiecību pētījumi ir skaidri parādījuši, ka šis toksīns ir trīs domēnu proteīns: katalītiskais, transmembrānas un receptoru. Ir bijis iespējams ģenētiski aizstāt difterijas toksīna dabisko receptoru saistošo domēnu ar dažādiem polipeptīdu hormoniem un citokīniem (piemēram, α-melanocītus stimulējošo hormonu [α-MSH], interleikīnu (IL) 2, IL-4, IL-6, IL-7, epidermas augšanas faktoru). Iegūtie himēriskie proteīni vai saplūšanas toksīni apvieno citokīna receptoru saistošo specifiskumu ar toksīna transmembrānas un katalītiskajiem domēniem. Katrā gadījumā tika pierādīts, ka saplūšanas toksīni selektīvi saindē tikai tās šūnas, kurām ir atbilstošais mērķa receptors. Pirmais no šiem ģenētiski modificētajiem saplūšanas toksīniem, DAB 389IL-2, pašlaik tiek vērtēts cilvēku klīniskajos pētījumos refraktāru limfomu un autoimūnu slimību ārstēšanai, kurās šūnām ar augstas afinitātes IL-2 receptoriem ir svarīga loma patogenezē.[ 7 ] Ir pierādīts, ka DAB 389 IL-2 ievadīšana ir droša, labi panesama un spēj izraisīt ilgstošu slimības remisiju bez nopietnām blakusparādībām. Visticamāk, ka uz difterijas toksīna bāzes veidotie saplūšanas toksīni kļūs par nozīmīgiem jauniem bioloģiskiem līdzekļiem specifisku audzēju vai slimību ārstēšanai, kurās var iedarboties uz specifiskiem šūnu virsmas receptoriem.


 [
[