
Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Pētījumā uzsvērta nepieciešamība pēc šūnu tipam specifiskas HIV terapijas.
Pēdējā pārskatīšana: 02.07.2025
Ilinoisas Universitātes pētnieki ir pierādījuši, cik svarīgi HIV ārstēšanā ir mērķtiecīgi iedarboties uz specifiskiem šūnu tipiem. Viņu pētījums, kas publicēts žurnālā "Proceedings of the National Academy of Sciences", ir viens no pirmajiem, kurā aplūkota HIV latentuma modulācijas diferenciālā vai šūnu tipam specifiskā ietekme uz mieloīdām šūnām, kas ir imūnšūnu veids, kas tiek ražots kaulu smadzenēs.
Viens no galvenajiem šķēršļiem HIV infekcijas izskaušanā ir latentuma jeb perioda, kurā inficētā šūna atrodas neaktīvā stāvoklī un nevar ražot vīrusu, pārvaldība. Latentās HIV šūnas organismā uzkrājas vietās, kas pazīstamas kā rezervuāri. Latentās rezervuāri ir problemātiski, jo tie var sākt ražot vīrusu jebkurā laikā.
Pilnīgai slimības izskaušanai būtu nepieciešams no organisma izvadīt visas latentās šūnas vai pastāvīgi rezistenci pret aktivācijas stimuliem. Tomēr reaktivāciju var izraisīt dažādi faktori, tostarp signāli, kas virza mieloīdo šūnu diferenciāciju.
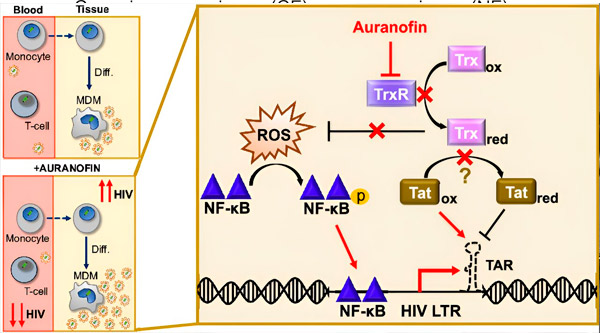
HIV latentuma regulēšana monocītu izcelsmes makrofāgos (MDM) var radīt vīrusu izplatīšanās risku. Monocītu diferenciācija makrofāgos var izraisīt HIV reaktivāciju, potenciāli veicinot vīrusu izplatīšanos audos (augšā pa kreisi). Klīniskais kandidāts auranofīns samazina vīrusu DNS līmeni asinīs un veicina HIV latenci T šūnās un monocītos, bet izraisa HIV reaktivāciju MDM (apakšā pa kreisi). MDM gadījumā mēs izvirzām hipotēzi, ka TrxR inhibīcija ar auranofīnu noved pie reaktīvo skābekļa sugu (ROS) uzkrāšanās, kas inducē NF-κB aktivāciju un HIV LTR promotera aktivāciju (pa labi). TrxR inhibīcija potenciāli samazina substrāta reducēšanos, ļaujot Tat proteīnam palikt priekšroku oksidētam, kur tas var saistīties ar TAR un uzsākt HIV transkripciju. Avots: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2313823121
Gadiem ilgi HIV izārstēšanas pētījumi ir koncentrējušies uz divām pieejām, kas pazīstamas kā "šoks un nogalināšana" un "bloķēšana un bloķēšana". Pirmā darbojas kombinācijā ar antiretrovīrusu terapiju, lai aktivizētu latentā stāvoklī inficētas šūnas un iznīcinātu tās ar apoptozes jeb ieprogrammētas šūnu nāves palīdzību, savukārt otrā piespiež inficētās šūnas nonākt dziļā latentā stāvoklī, no kura tās pašas nevar atkārtoti aktivizēties.
Pētījumi, kas saistīti ar šīm metodēm, tradicionāli ir koncentrējušies uz balto asinsķermenīšu veidu, ko sauc par T šūnām, kuras ir galvenais HIV infekcijas mērķis. Tomēr latentās rezervuāras sastāv ne tikai no T šūnām; patiesībā tās satur desmitiem dažādu šūnu tipu, katram ar saviem unikāliem HIV gēnu ekspresijas modeļiem.
"Pat vienas līnijas ietvaros pastāv milzīga šūnu daudzveidība," sacīja Kolins Kīfers, mikrobioloģijas docents un raksta autors. "Reakcijas mainīgums šajos rezervuāros palielinās ar katru jaunu šūnu tipu."
Aleksandra Blanko, Kīfera laboratorijas doktorante, vēlējās pētīt šūnu tipus, kas tradicionālajos HIV pētījumos nebija pamanīti. Koncentrējoties uz mieloīdām šūnām, viņa izveidoja klonu bibliotēku, kurā bija 70 latentā stāvoklī inficētu monocītu populācijas. Pēc tam Blanko analizēja klonu populācijas un to reakcijas uz aktivāciju. Reakcijas bija ļoti dažādas, izceļot lielo daudzveidību viena šūnu tipa ietvaros.
Šis novērojums radīja jaunu jautājumu: vai dažādiem šūnu tipiem tiešām ir atšķirīga reakcija uz HIV latentuma terapiju? Patiešām, viņu atklājumi parādīja, ka dažas HIV latentuma terapijas var veicināt latentumu T šūnās un monocītos, savukārt tās var mainīt latentumu makrofāgos.
"Ne visas ķermeņa šūnas ir vienādas," sacīja Kīfers. "Tāpēc ir loģiski, ka ne visas inficētās šūnas reaģēs uz vīrusu vienādi."
Viņu rakstā uzsvērta nepieciešamība turpmākajās HIV ārstēšanas metodēs ņemt vērā visus šūnu tipus un to, kā katra šūna varētu reaģēt uz potenciālajām terapijām.
Viņu atklājumi balstās uz pētījumu, ko veica Rojs Dars, bijušais Ilinoisas bioinženierijas profesors, kura laboratorija pētīja HIV gēnu ekspresijas neviendabīgumu.
"Viņš to sāka, un mēs to pārņēmām un izveidojām līdz vietai, kur tas ir šodien," sacīja Kīfers. "Tātad sadarbība patiešām deva impulsu šiem rezultātiem. Tā ir kļuvusi par jaunu virzienu mūsu laboratorijai, un mēs par to esam ļoti sajūsmināti."
Blanco analīzes papildu un negaidīts atklājums atklāja izmaiņas šūnu lielumā un formā, reaģējot uz infekciju, kas liecina, ka HIV var mainīt šūnu morfoloģiju. Blanco nākamais mērķis ir identificēt bioloģiskos mehānismus, kas ir šo fenotipisko izmaiņu pamatā.
Kīfers un viņa laboratorijas locekļi arī cer atkārtot savus rezultātus, kas galvenokārt tika iegūti šūnu līnijā, primārajās šūnās. Rezultātu atkārtota izmantošana cilvēkam līdzīgākā modelī uzlabotu pētījuma klīnisko nozīmīgumu, skaidroja Kīfers.
"Mēs vēlētos veikt plašākus skrīningus T šūnās, monocītos un makrofāgos, lai identificētu potenciālās zāles, kas varētu iedarboties uz visiem šiem šūnu tipiem," sacīja Blanko. "Mēs varētu atrast vēl vairāk molekulu, kas neuzvedas šūnu tipam specifiskā veidā."
