
Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Jauni ģenētiskie mehānismi varētu būt terapeitiskais mērķis gliomas ārstēšanā
Pēdējā pārskatīšana: 02.07.2025
Pētījums, ko veica Ši-Juaņa Čena (Ši-Juan Cheng), Kena un Rūtas Deiviju Neiroonkoloģijas nodaļas profesora Neiroloģijas katedrā, laboratorijā, ir atklājis jaunus mehānismus, kas ir pamatā alternatīviem RNS splaisēšanas notikumiem gliomas audzēja šūnās, kas varētu kalpot kā jauni terapeitiskie mērķi. Pētījuma rezultāti ir publicēti žurnālā " Journal of Clinical Investigation".
"Mēs esam atraduši citu veidu, kā ārstēt gliomu, izmantojot alternatīvās splaisēšanas lēcu, un atklājuši jaunus mērķus, kas iepriekš nav identificēti, bet ir svarīgi gliomas ļaundabīgo audzēju veidošanās procesā," sacīja Sjao Songs, MD, PhD, neiroloģijas asociētais profesors un pētījuma vadošais autors.
Gliomas ir visizplatītākais primārā smadzeņu audzēja veids pieaugušajiem, un tās rodas no gliālajām šūnām, kas atrodas centrālajā nervu sistēmā un atbalsta blakus esošos neironus. Gliomas ir ļoti izturīgas pret standarta ārstēšanas metodēm, tostarp staru terapiju un ķīmijterapiju, audzēja ģenētiskās un epigenetiskās heterogenitātes dēļ, kas uzsver nepieciešamību atrast jaunus terapeitiskos mērķus.
Iepriekšējais Čenga laboratorijas pētījums, kas publicēts žurnālā Cancer Research, parādīja, ka svarīgais splaisēšanas faktors SRSF3 ir ievērojami paaugstināts gliomās, salīdzinot ar normālām smadzenēm, un SRSF3 regulētā RNS splaisēšana veicina gliomas augšanu un progresēšanu, ietekmējot vairākus šūnu procesus audzēja šūnās.
RNS splaisēšana ir process, kas ietver intronu (RNS nekodējošo reģionu) noņemšanu un eksonu (kodējošo reģionu) savienošanu, lai izveidotu nobriedušu mRNS molekulu, kas atbalsta gēnu ekspresiju šūnā.
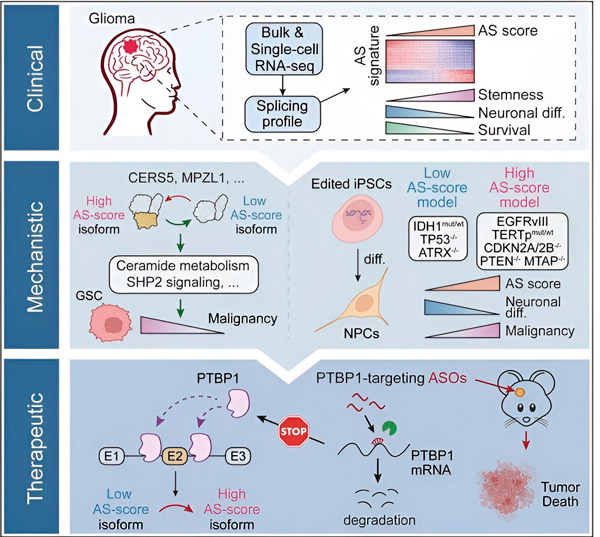
Šajā pētījumā zinātnieki centās identificēt izmaiņas alternatīvajā splaisingā gliomas audzēja šūnās, mehānismus, kas ir šo izmaiņu pamatā, un noteikt to potenciālu kā terapeitiskiem mērķiem.
Izmantojot skaitļošanas metodes un RNS sekvencēšanas tehnoloģijas, pētnieki pētīja splaisinga izmaiņas gliomas audzēja šūnās no pacientu paraugiem. Lai apstiprinātu šīs izmaiņas, viņi izmantoja CRISPR gēnu rediģēšanas tehnoloģijas, lai ieviestu dažādas gliomas vadītāja mutācijas gliomas modeļos, kas iegūti no cilvēka inducētām pluripotentām cilmes šūnām (iPSC).
Viņi atklāja, ka šīs splicēšanas izmaiņas pastiprina epidermas augšanas faktora receptora III (EGFRIII) variants, kas, kā zināms, ir pārmērīgi ekspresēts daudzos audzējos, tostarp gliomās, un ko kavē mutācija IDH1 gēnā.
Pētnieki ir apstiprinājuši divu RNS splicēšanas notikumu funkciju, kas rada dažādas olbaltumvielu izoformas ar atšķirīgām aminoskābju sekvencēm.
"Tikai viena no šīm izoformām var veicināt audzēja augšanu, atšķirībā no otras izoformas, kas parasti tiek ekspresēta normālās smadzenēs. Audzēji izmanto šo mehānismu, lai selektīvi ekspresētu audzēju veicinošo izoformu virs normālās smadzeņu izoformas," sacīja Songs.
Pēc tam komanda analizēja augšupējos RNS saistošos proteīnus un atklāja, ka PTBP1 gēns regulē audzēju veicinošu RNS splaisošanu gliomas šūnās. Izmantojot ortotopiskas gliomas modeli imūndeficīta pelēm, pētnieki mērķēja uz PTBP1 ar antisensu oligonukleotīdu (ASO) terapiju, kas galu galā nomāca audzēja augšanu.
"Mūsu dati izceļ alternatīvās RNS splicēšanas lomu gliomas ļaundabīguma un heterogenitātes ietekmēšanā, kā arī tās potenciālu kā terapeitisku ievainojamību pieaugušo gliomu ārstēšanā," rakstīja pētījuma autori.
Nākamais solis pētniekiem ir izpētīt PTBP1 mērķauditorijas potenciālu, lai izraisītu pretvēža imūnreakciju, sacīja Song.
"Izmantojot ilgstošas lasīšanas RNS sekvencēšanas analīzi, mēs atklājām, ka PTBP1 mērķtiecīga ievadīšana gliomas šūnās izraisa vairāku alternatīvi splicētu transkriptu veidošanos, kas nav sastopami normālos audos. Tāpēc mūsu nākamais projekts ir noskaidrot, vai šī izoforma var ģenerēt dažus antigēnus, lai imūnsistēma varētu labāk atpazīt audzēju," sacīja Songs.
Song arī piebilda, ka viņu komanda ir ieinteresēta analizēt gliomas pacientu ne-audzēja šūnu, piemēram, imūnšūnu, splaisinga izmaiņas.
"Mēs jau zinām, ka splaisošana ir ļoti svarīga šūnas funkcijas regulēšanai, tāpēc tai vajadzētu ne tikai regulēt audzēja ļaundabīgos audzējus, bet arī regulēt imūnšūnu funkciju, lai noteiktu, vai tās var efektīvi iznīcināt vēzi. Tāpēc mēs veicam arī dažas bioinformātikas analīzes audzējā infiltrētās imūnšūnās, lai noskaidrotu, vai splaisošanā ir notikušas izmaiņas pēc tam, kad imūnšūna ir infiltrējusies audzējā."
"Mūsu mērķis ir noteikt alternatīvās splicēšanas lomu imūnsupresīvās audzēja mikrovides veidošanā un identificēt potenciālos mērķus imunoterapiju efektivitātes uzlabošanai gliomas gadījumā," sacīja Songs.
