
Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Mākslīgais intelekts atklāj agrīnas stadijas prostatas vēzi, ko patologi nepamana
Pēdējā pārskatīšana: 23.08.2025
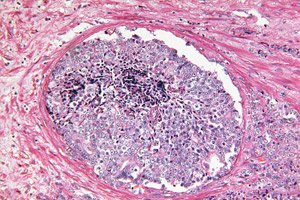 ">
">Zinātniskie ziņojumi liecina, ka mākslīgais intelekts spēj atpazīt slēptas audzēja morfoloģiskas pazīmes prostatas biopsijās, kuras patologs iepriekš uzskatīja par labdabīgām. Dziļās mācīšanās modelis, kas apmācīts, izmantojot vāji uzraudzītu pieeju, paredzēja, kuriem vīriešiem ar paaugstinātu PSA līmeni nākamo 30 mēnešu laikā attīstīsies klīniski nozīmīgs prostatas vēzis (ISUP > 1) un kuri vismaz 8 gadus paliks bez vēža. Tas paver durvis agrīnai riska stratifikācijai tūlīt pēc sākotnējās "tīras" biopsijas un var palīdzēt izlemt, kam patiešām ir nepieciešamas atkārtotas invazīvas procedūras un pastiprināta uzraudzība.
Pētījuma pamatojums
Primārā prostatas adatas biopsija bieži vien dod viltus negatīvus rezultātus: ievērojama daļa klīniski nozīmīga vēža gadījumu paliek “ārpus ekrāna”, īpaši veicot tradicionālo sistemātisko TRUS biopsiju. MRI vadības ieviešana ir palielinājusi klīniski nozīmīga vēža atklāšanas īpatsvaru un samazinājusi nevajadzīgu atkārtotu procedūru skaitu, taču pat ar modernām stratēģijām daži agresīvi audzēji paliek neatklāti. Klīniskā dilemma paliek nemainīga: kurš jānovēro pēc “tīras” biopsijas un kurš jānosūta uz agrīnu atkārtotu biopsiju, lai neaizkavētu diagnozi un nepārslogotu pacientus ar invazīvām intervencēm.
Šīs problēmas risināšanas bioloģiskais pamats ir TINT (audzēja norādīto/normālo audu indikācijas) fenomens: audzējs “pārkonfigurē” apkārtējos šķietami normālos orgāna audus, atstājot tajos vājas, bet sistemātiskas pēdas – sākot no stromas remodelācijas un hipoksijas līdz vielmaiņas izmaiņām. Šīs izmaiņas ir aprakstītas eksperimentālos modeļos un pacientiem ar prostatas vēzi, un tās korelē ar audzēja agresivitāti, kas padara “normālos” audus par potenciālu diagnostisko signālu avotu, pat ja biopsijas kodolā nav acīmredzamu vēža dziedzeru.
Digitālās patoloģijas un dziļās mācīšanās metožu mērķis ir iegūt šādas “smalkas” lauka pazīmes no standarta H&E griezumiem. Atšķirībā no klasiskās morfoloģijas, kas koncentrējas uz acīmredzamām audzēja struktūrām, algoritmi var uztvert izkliedētus modeļus stromā un epitēlijā, kas saistīti ar audzēja klātbūtni citā orgāna daļā. Tas paver ceļu riska stratifikācijai tūlīt pēc negatīvas biopsijas: augsts stikla “rādītājs” norāda uz agrīnas atkārtotas biopsijas vai MRI vadības lietderību, zems – uz saudzīgāku novērošanu.
Šī ir ideja, kas ir jaunā pētījuma pamatā žurnālā “Scientific Reports”: autori pārbaudīja, vai mākslīgais intelekts (MI) var paredzēt klīniski nozīmīgu prostatas vēzi nākamo 30 mēnešu laikā, pamatojoties uz TINT biopsiju morfoloģiskajām norādēm. Darbs balstās uz iepriekš prezentēta pētījuma līniju un veido lietišķu pamatu “lauka” digitālo biomarķieru ieviešanai pacientu maršrutēšanā pēc sākotnējās “tīras” biopsijas.
Kā tas tika paveikts: dizains, dati, algoritms
Autori retrospektīvi apkopoja 232 vīriešu kohortu ar paaugstinātu PSA līmeni un sākotnējo adatas biopsijas secinājumu kā "labdabīgu" (pēc tehniskās kontroles galīgajā analīzē tika iekļauti 213 pacienti un 587 griezumi; biopsijas 1997.–2016. gadā, Ūmeo, Zviedrija). Katrs pacients tika saskaņots ar "spoguļa" pāri pēc vecuma, diagnozes gada un PSA līmeņa: pusei prostatas vēzis tika diagnosticēts vēlāk (≤30 mēneši), otra puse vismaz 8 gadus nebija vēža. H&E preparāti tika digitalizēti (20×), sagriezti 256×256 pikseļu flīzēs un padoti CLAM (klasterizācijas ierobežotas uzmanības vairāku instancu mācīšanās) — modernai, vāji uzraudzītai shēmai, kurā zināms tikai pacienta liktenis, nevis katra pikseļa marķējums. Pazīmes tika iegūtas ar ResNet18, kas iepriekš apmācīts 57 histopatoloģijas datu kopās. Galarezultāts ir binārs: zems risks (labdabīgs/ISUP1) pret augstu risku (ISUP2-5).
Prognozēšanas precizitāte
Neatkarīgā testā modelis sasniedza AUC 0,81 visos preparātos un AUC 0,82 pacienta līmenī. Pie sliekšņa, kas nodrošināja pieņemamu līdzsvaru, jutība bija 0,92 ar viltus pozitīvo rezultātu biežumu 0,32 (pacienta līmenī). Citiem vārdiem sakot, starp cilvēkiem, kuru sākotnējā biopsija "neizdevās", mākslīgais intelekts pareizi atzīmēja lielāko daļu no tiem, kuriem drīz vien tika apstiprināts klīniski nozīmīgs vēzis, lai gan tas notika ar dažām viltus trauksmēm. Klīnikai tas ir signāls: "labdabīga" biopsijas atbilde ≠ nulle risks, un to var kvantitatīvi stratificēt ar digitālo stiklu.
Ko tieši mākslīgais intelekts "pamana" "normālos" audos?
Interpretācija, izmantojot UMAP un uzmanības kartes, parādīja, ka stromas izmaiņas ir visinformatīvākās:
- Vairāk kolagēna stromā (matricas sablīvēšanās, “fibroze”);
- Mazāk gludo muskuļu šūnu ap dziedzeriem;
- Retāk sastopami smalki signāli dziedzeru epitēlijā, iespējams, zem pieejamās izšķirtspējas samazināšanas.
Šis modelis atbilst TINT (audzēja norādīta/normālu audu indikācija) koncepcijai: pat "norma" orgānā, kurā audzējs ir paslēpts, tiek pārveidota tā ietekmē un atšķiras no "normas" orgānā bez audzēja. Vēzis ir ne tikai perēklis, bet arī lauks, un mākslīgais intelekts iemācās nolasīt lauka efektu.
Kā šī pieeja ir noderīga praksē — iespējamie scenāriji
- Uz risku balstīta atkārtota biopsija: augsts mākslīgā intelekta līmenis uz "tīra" stikla — arguments par labu agrīnai atkārtotai biopsijai vai MRI vadlīnijām, nevis gaidīšanai.
- Monitoringa personalizācija: zems ātrums līdzsvaro trauksmi pēc "robežstāvokļa" MRI un ļauj mērenot monitoringa intensitāti.
- TINT modeļu apmācība: uzmanības kartes un interaktīvie pārklājumi palīdz patologiem saskatīt smalkus laukus ap vēzi, uzlabojot ziņojumu konsekvenci.
Ir svarīgi saprast ierobežojumus
Tas ir viens centrs Zviedrijas ziemeļos (galvenokārt baltās rases iedzīvotāji), dizains ir retrospektīvs, sākotnējās biopsijas tika veiktas bez MRI vadības (sistemātiskas TRUS biopsijas), un marķieri ir nākotnes rezultāti, nevis "slēpts audzējs uz tā paša preparāta". Neatkarīgos centros/skeneros vēl nav veikta ārēja validācija, kā arī nav prospektīva pētījuma par algoritma ietekmi uz klīniskajiem lēmumiem un rezultātiem. Viltus pozitīvo rezultātu līmenis joprojām ir ievērojams - modelis neaizstāj ārstu, bet pievieno varbūtības slāni kopīgai lēmumu pieņemšanai.
Kas tālāk: ieviešanas ceļvedis
- Daudzcentru ārējā validācija (dažādi skeneri, protokoli, etniskās grupas).
- Prospektīvie lēmumu pētījumi: vai AI rādītājs maina pacienta trajektoriju (laiks līdz diagnozes noteikšanai, nevajadzīgu atkārtotu biopsiju skaits, pārlieku augsta/nepietiekama diagnoze).
- Integrācija ar MRI un klīniku: kombinētie modeļi (PSA, MRI PIRADS, klīniskie faktori + TINT vērtējums saskaņā ar H&E).
- Tehniskie soļi: digitalizācijas standartizācija, datu novirzes kontrole, izskaidrojamība (rutīnas uzmanības pārklājumi).
Avots: Chelebian E., Avenel C., Järemo H., Andersson P., Bergh A., Wählby C. u.c. Audzēja atklāšana, kas norāda uz morfoloģiskām izmaiņām labdabīgās prostatas biopsijās, izmantojot mākslīgo intelektu. Zinātniskie ziņojumi (Nature Portfolio), publicēti 2025. gada 21. augustā. DOI: https://doi.org/10.1038/s41598-025-15105-6
