
Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Trakumsērga bērniem
Raksta medicīnas eksperts
Pēdējā pārskatīšana: 04.07.2025
Trakumsērga jeb hidrofobija ir akūta vīrusu slimība, kas izplatās ar inficēta dzīvnieka kodumu, ar nervu sistēmas bojājumiem un smagas encefalīta attīstību ar letālu iznākumu.
Epidemioloģija
Trakumsērgas vīruss, kas ir sabiedrības veselības posts kopš seniem laikiem, pašlaik katru gadu izraisa aptuveni 59 000 cilvēku nāves gadījumu, un gandrīz visi šie nāves gadījumi tiek pārnesti ar suņu kodumiem. Tam ir ievērojama ekonomiskā ietekme uz jaunattīstības valstīm, īpaši Āfrikā un Āzijā, kuras spēj segt vismazākos šādus zaudējumus. Tomēr, neskatoties uz gandrīz 100 % mirstības līmeni, suņu trakumsērga ir pilnībā novēršama slimība, un vēsturiski suņu trakumsērgas izskaušanas piemēri attīstītajā pasaulē to apliecina. [ 1 ]
Cēloņi trakumsērga
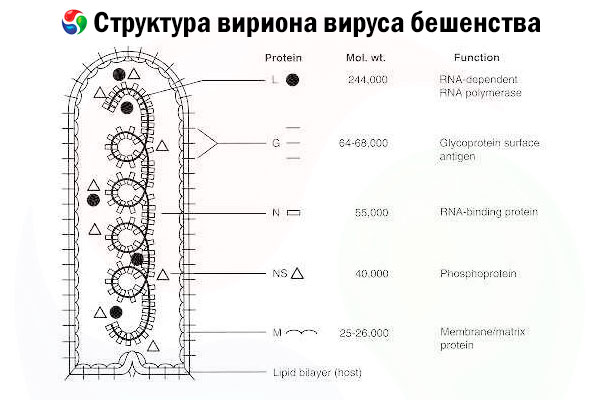
Slimības izraisītājs ir trakumsērgas vīruss (RV) — rabdovīrusu dzimtas negatīvas virknes RNS vīruss, kura izmērs ir aptuveni 60 nm × 180 nm.
Tas sastāv no iekšējā olbaltumvielu kodola jeb nukleokapsīda, kas satur nukleīnskābi, un ārējās membrānas — lipīdus saturoša dubultslāņa, kas pārklāts ar transmembrānu glikoproteīnu tapām. Tam ir relatīvi vienkārša modulāra genoma struktūra un tas kodē piecus strukturālus proteīnus:
- RNS atkarīgā RNS polimerāze (L),
- nukleoproteīns (N),
- fosforilēts proteīns (P),
- matricas proteīns (M) un
- ārējās virsmas glikoproteīns (G).
N, P un L proteīni kopā ar genoma RNS veido ribonukleoproteīnu kompleksu. G ir vienīgais RV antigēns, kas spēj inducēt RV neitralizējošo antivielu veidošanos, kuras ir galvenie imūnsistēmas efektori pret letālu RV infekciju. No otras puses, ir pierādīts, ka ribonukleoproteīnu komplekss ir galvenais RV antigēns, kas spēj inducēt CD4+ T šūnas, kas var veicināt RV neitralizējošo antivielu veidošanos, izmantojot intrastrukturālu antigēnu atpazīšanu.[ 2 ] Ribonukleoproteīnu kompleksam var būt svarīga loma imunoloģiskās atmiņas un ilgtermiņa imunitātes izveidē.[ 3 ]
Klasifikācija un antigēnu veidi
Lissavīrusa ģints ietver trakumsērgas vīrusu un antigēniski un ģenētiski radniecīgus trakumsērgas vīrusus: Lagosas, Mokolas un Duvenhāges sikspārņu vīrusus, kā arī divus iespējamus Eiropas sikspārņu lisavīrusu apakštipus. Krustotās aizsardzības pētījumi liecina, ka dzīvnieki, kas imunizēti ar tradicionālajām trakumsērgas vakcīnām, var nebūt pilnībā aizsargāti, ja tos inficē ar citiem lisavīrusiem.
Trakumsērgas vīrusus var klasificēt kā fiksētus (adaptētu, pārnesot tos dzīvniekos vai šūnu kultūrā) vai ielu (savvaļas tipa). Monoklonālo antivielu un ģenētiskās sekvencēšanas izmantošana, lai diferencētu ielu trakumsērgas vīrusus, ir palīdzējusi identificēt vīrusu variantus, kuru izcelsme ir galvenajos saimnieku rezervuāros visā pasaulē, un ieteikt iespējamos cilvēku iedarbības avotus, ja pacienta gadījumā anamnēzē nebija dzīvnieka koduma.[ 8 ]
Pathogenesis
Galvenais infekcijas rezervuārs un avots savvaļas dzīvnieku vidū ir vilki, lapsas, šakāļi, sikspārņi, bet mājdzīvnieku vidū - suņi un kaķi, reti - zirgi, liellopi, cūkas, žurkas utt. Infekcijas pārnešana no cilvēka uz cilvēku, lai gan iespējama, ir ārkārtīgi reta. Šī ir tipiska zoonotiska infekcija. Cilvēki inficējas ar trakumsērgu galvenokārt no suņiem.
Pēc tam, kad cilvēku sakož slims dzīvnieks, vīruss vairojas koduma vietas muskuļu audos un pēc tam, sasniedzot sensorisko perifēro nervu galus, izplatās centripetāli, sasniedzot motoros neironus. Laiks, kas nepieciešams, lai vīruss pārvietotos un tiktu skartas smadzenes, ir atkarīgs no koduma vietas. Smagu galvas un sejas kodumu gadījumā vīruss var sasniegt centrālo nervu sistēmu 15–20 dienu laikā, un nelielu rumpja un ekstremitāšu ādas bojājumu un līdz ar to nelielas patogēna devas gadījumā vīrusa pārvietošanās process uz centrālo nervu sistēmu var aizkavēties vairākus mēnešus vai pat līdz 1–1,5 gadiem. Sasniedzot centrālo nervu sistēmu, vīruss fiksējas smadzeņu un muguras smadzeņu audos, galvenokārt iegarenās smadzenes, Amona raga un smadzeņu pamatnes neironos. Muguras smadzenēs visvairāk tiek skarti aizmugurējie ragi. No centrālās nervu sistēmas vīruss centrbēdzes ceļā pa nervu stumbriem nonāk siekalu dziedzeros, kur tas vairojas un izdalās ar siekalām.
Trakumsērgas patogenēzes koncepcijas
RV ir plašs saimnieku loks un var inficēt gandrīz visus zīdītājus. Lai gan ir ziņots par vairākiem RV pārnešanas ceļiem, dabiska inficēšanās visbiežāk notiek ar kodumu. Papildus kodumiem, ar RV inficētu līķu lietošana uzturā var veicināt trakumsērgas vīrusa infekciju polārlapsām, un ir atklāts, ka RV saskare ar gļotādām ir vēl viens iespējamais pārnešanas ceļš.[ 9 ] Dažos neparastos apstākļos, piemēram, nejaušas RV izlaišanas aerosola veidā laboratorijā vai RV aerosola veidā alās, kurās dzīvo liels skaits sikspārņu,[ 10 ] var notikt aerosola pārnešana.
Pagaidām nav skaidrs, vai ielu RV un pelēm adaptēti vai audu kultūrām adaptēti RV celmi replicējas inokulācijas vietā pirms nonākšanas CNS. Lai gan eksperimentāla jaunu kāmju vai jenotu intramuskulāra inficēšana ar ielu RV atklāja RV replikāciju svītroto muskuļu šūnās, pirms vīruss iebruka motoro neironu aksonos pāri neiromuskulāriem savienojumiem,[ 11 ][ 12 ] peļu intramuskulāra inficēšana ar pelēm adaptētu CVS-24 RV parādīja, ka RV migrē tieši uz CNS bez iepriekšējas replikācijas inokulācijas vietā.[ 13 ] Nonākot nemielinētu aksonu galos, RV retrogradi tiek transportēts uz šūnas ķermeni.
Jaunākie atklājumi liecina, ka aksonu pūslīšu transports varētu būt galvenā stratēģija virionu pārvietošanai lielos attālumos aksonos.[ 14 ] Ir lēsts, ka RV migrē aksonos ar ātrumu 3 mm/h.[ 15 ] Pēc tam infekcija izplatās pa neironu ķēdi, kas savienota ar sinaptiskiem savienojumiem. Tomēr precīzs mehānisms, kas veicina transsinaptisko izplatīšanos, joprojām nav zināms. Pēc smadzeņu inficēšanas vīruss centrbēdzes ceļā izplatās uz perifēro un autonomo nervu sistēmu daudzos perifērajos orgānos.[ 16 ] Infekcijas cikla pēdējā posmā RV migrē uz siekalu dziedzeriem; pēc replikācijas mukogēnās acinārajās šūnās tas tiek izdalīts siekalās un ir gatavs pārnešanai uz nākamo saimnieku.[ 17 ]
Attiecībā uz trakumsērgas vīrusa izraisītu patoloģiju, apoptotiska šūnu nāve ir ierosināta kā potenciāls patogēns mehānisms eksperimentālos trakumsērgas modeļos pelēm, kas inficētas ar fiksētu RV celmu.[ 18 ] Patogēnisks mehānisms, kas var veicināt trakumsērgai raksturīgo dziļo CNS disfunkciju, var būt traucēta neironu funkcija. Ir pierādīts, ka RV inficētos neironos gēnu ekspresija ir ievērojami samazināta, kā rezultātā tiek vispārēji nomākta olbaltumvielu sintēze,[ 19 ] un vairāki pētījumi ir parādījuši traucētu neirotransmisiju pēc RV infekcijas. Dzjans pierādīja, ka acetilholīna receptoru antagonista saistīšanās ar inficētu žurku smadzeņu homogenātiem bija samazināta, salīdzinot ar kontroles grupu.[ 20 ] RV inficētās žurku smadzenēs tika novērota arī traucēta serotonīna, neirotransmitera, kas iesaistīts miega cikla, sāpju uztveres un uzvedības kontrolē, izdalīšanās un saistīšanās.[ 21 ], [ 22 ] Papildus neirotransmisijas ietekmēšanai labā kambara infekcija var ietekmēt arī jonu kanālus. Inficētām peļu neiroblastomas šūnām ir samazināta spriegumam jutīgu nātrija kanālu funkcionālā ekspresija, kas var novērst darbības potenciālus un galu galā izraisīt funkcionālus traucējumus.[ 23 ]
Papildus tam, ka CNS nav nopietnu patoloģisku bojājumu, lielākā daļa cilvēku trakumsērgas gadījumu neizraisa imūnreakciju 7 līdz 10 dienas pēc klīnisko pazīmju parādīšanās. Šīs būtiskās atšķirības starp trakumsērgas patogenezi un vairuma citu vīrusu vai baktēriju CNS infekciju patogenezi vēl vairāk apstiprina fakts, ka imūnsupresija ir vai nu neefektīva, vai arī kaitīga trakumsērgas iznākumam.[ 24 ] Zemais imūnreakcijas līmenis, kas bieži novērots trakumsērgas upuriem, ir mulsinošs, jo to nevar izskaidrot ar RV antigēnu slikto imunogenitāti. Faktiski RV G un nukleokapsīda proteīns ir spēcīgi B un T šūnu antigēni, ja tos ievada parenterāli. [ 25 ] Iespējamais skaidrojums zemajai imūnreakcijas pakāpei pret RV cilvēkiem vai dzīvniekiem ar trakumsērgu varētu būt tas, ka RV infekcija CNS izraisa imūnsupresiju, [ 26 ] un ir ierosināts, ka RV izmanto graujošu stratēģiju, tostarp apoptozes novēršanu un invāzijušo T šūnu iznīcināšanu. [ 27 ]
Novājināti RV celmi, kas ir adaptējušies neironālām šūnām, būtiski atšķiras no patogēniem ielu RV celmiem pēc savas neiroinvazivitātes, kas attiecas uz to spēju iekļūt CNS no perifērām vietām. Šajā ziņā audu kultūrām adaptētiem RV celmiem vai nu trūkst, vai arī ir tikai ierobežota spēja iekļūt CNS no perifērām vietām, turpretī ielu RV celmi vai pelēm adaptēti RV celmi, piemēram, CVS-24, ir ļoti invazīvi.[ 28 ] Galvenie RV neiroinvazijā iesaistītie faktori ir vīrusu uzņemšana, aksonu transports, transsinaptiskā izplatība un vīrusu replikācijas ātrums.
Līdz nesenam laikam mūsu zināšanas par RV patogenezi bija ierobežotas un galvenokārt balstījās uz aprakstošiem pētījumiem par ielu RV celmiem vai eksperimentālām infekcijām ar laboratorijā adaptētiem novājinātiem celmiem. Reversās ģenētikas tehnoloģijas parādīšanās ir ļāvusi mums identificēt vīrusu elementus, kas nosaka RV patogēno fenotipu, un labāk izprast mehānismus, kas iesaistīti trakumsērgas patogenezē.
Vīrusu elementu identificēšana, kas kontrolē trakumsērgas vīrusa iegūšanu, izplatīšanos un replikāciju
- Vīrusu elementi, kas iesaistīti vīrusa uztveršanā
RV infekcija sākas ar vīrusa piesaistīšanos iespējamam šūnu receptoram. Lai gan par RV receptoriem ir ierosinātas vairākas membrānas virsmas molekulas, tostarp nikotīna acetilholīna receptors,[ 29 ] neironu šūnu adhēzijas molekula[ 30 ] un zemas afinitātes neirotrofīnu receptors p75 NTR,[ 31 ] joprojām nav skaidrs, vai šīm molekulām faktiski ir kāda loma trakumsērgas vīrusa dzīves ciklā. Šajā kontekstā nesen ir pierādīts, ka RV G–p75 NTR mijiedarbība nav nepieciešama primāro neironu RV infekcijai.[ 32 ] Pēc saistīšanās ar receptoru RV tiek internalizēts, izmantojot adsorptīvu vai receptoru mediētu endocitozi.[ 33 ] Zemā pH vide endosomu nodalījumā pēc tam izraisa RV G konformācijas izmaiņas, kas izraisa vīrusa membrānas saplūšanu ar endosomu membrānu, tādējādi atbrīvojot RNP citoplazmā.[ 34 ] Vīrusiem RV G ir izšķiroša loma vīrusu uzņemšanā, visticamāk, mijiedarbojoties ar iespējamiem šūnu receptoriem, kas veicina ātru uzņemšanu. Šajā sakarā ir pierādīts, ka audu kultūrai adaptētu RV celmu (piemēram, ERA, HEP un CVS-11) patogenitāte korelē ar determinanta klātbūtni, kas atrodas G proteīna III antigēniskajā vietā. [ 35 ] Arg → Gln mutācija 333. pozīcijā šajā ERA G proteīna antigēnajā vietā izraisīja septiņas reizes aizkavētu Gln333 RV varianta internalizāciju, salīdzinot ar savvaļas tipa variantu. Asn194→Lys194 mutācija RV G virionā, kas izskaidro patogēnā fenotipa atkārtotu parādīšanos, bija saistīta ar ievērojamu internalizācijas laika samazināšanos.[ 36 ] Turklāt eksperimenti ar himēriskiem RV parādīja, ka RV virionu internalizācijai nepieciešamais laiks ievērojami palielinājās un patogenitāte ievērojami samazinājās pēc tam, kad ļoti patogēnā SB RV celma G gēns, kas tika iegūts no ar sudrabu atvasinātā sikspārņiem saistītā celma RV-18 cDNS klona,[ 37 ] tika aizstāts ar ļoti novājinātā SN celma gēnu, kas tika izolēts no SAD B19 RV vakcīnas celma cDNS klona.[ 38 ] Kopā šie dati apstiprina uzskatu, ka vīrusa uzņemšanas kinētika, kas ir RV G funkcija, ir galvenais RV patogenitātes noteicošais faktors.
- Vīrusu elementi, kas iesaistīti vīrusu izplatīšanā un pārnešanā
Trakumsērgas vīrusa unikāla īpašība ir tā spēja izplatīties no šūnas uz šūnu. Novērojums, ka Gln333 ERA variants in vitro zaudē no pH atkarīgo šūnu-šūnu saplūšanas aktivitāti [ 39 ] un uzrāda ievērojami samazinātu spēju izplatīties no šūnas uz šūnu [ 40 ], liecina, ka RV G arī spēlē galveno lomu šūnu-šūnu izplatībā un līdz ar to vīrusa pārnešanā, iespējams, pateicoties tā fuziogēnajai aktivitātei. Šo iespēju vēl vairāk apstiprina atklājums, ka patogēnā RV revertanta SPBNGAK izplatīšanās ātrums ir gandrīz divreiz lielāks nekā nepatogēnajam SPBNGA variantam noteiktais. Interesanti, ka Asn 194 → Lys 194 mutācija G SPBNGAK izraisīja pH sliekšņa nobīdi membrānas saplūšanai uz augstāku pH līmeni, apstiprinot hipotēzi, ka augstāks pH slieksnis membrānas saplūšanai ir saistīts ar palielinātu vīrusa izplatību. [ 41 ]
Pētījumi par RV infekcijas transneironālajiem indikatoriem žurkām [ 42 ] un rēzus pērtiķiem [ 43 ] ir parādījuši, ka trakumsērgas vīruss migrē tikai retrogrādā virzienā aksonos. Lai gan vairāki RV proteīni ir iesaistīti neironu transporta mehānismos, šķiet, ka RV G spēlē dominējošu lomu RV infekcijas transneironālajā izplatībā. Piemēram, lai gan perifēra infekcija ar zirgu infekciozās anēmijas vīrusu (EIAV), kas pseidotipizēts ar RV G, izraisa vīrusa pārnesi uz muguras smadzenēm, tas pats EIAV, kas pseidotipizēts ar vezikulārā stomatīta vīrusu G, nespēja iekļūt nervu sistēmā. [ 44 ] Turklāt tika konstatēts, ka ERA G Arg 333 → Gln 333 mutanta vīrusa izplatība CNS ir ievērojami samazināta, salīdzinot ar savvaļas tipa mutantu, kas vēl vairāk liecina par neskarta RV G funkciju transsinaptiskajā izplatībā. Tomēr vispārliecinošākie pierādījumi par RV G svarīgo lomu transsinaptiskajā transportā ir iegūti no peļu intrakraniālas inficēšanas ar rekombinantu G deficītu RV vīrusu, kas parādīja, ka infekcija aprobežojas ar neironiem inokulācijas vietā bez jebkādām izplatīšanās pazīmēm uz sekundārajiem neironiem.[ 45 ] Tomēr ir iespējams, ka papildus RV G, arī RV M spēlē lomu vīrusa izplatībā un līdz ar to transsinaptiskajā transportā. Šajā sakarā tika pierādīts, ka himēriskā SN-BMBG RV varianta, kas satur gan M, gan G no ļoti patogēnā SB, izplatība bija ievērojami lielāka nekā himēriskā SN-BG vai SN-BM varianta izplatība, kas satur attiecīgi G un M no SB, kas liecina, ka optimālai M mijiedarbībai ar G var būt svarīga loma vīrusa izplatībā no šūnas uz šūnu. [ 46 ] Tā kā RV M atbalsta vīrusa pumpurošanos, [ 47 ] ir iespējams, ka efektīvāka RV SN-BMBG himēriskā varianta izplatība ir saistīta ar optimālu vīrusa pumpurošanos postsinaptiskajā membrānā.
Jaunākie pētījumi liecina, ka mijiedarbība starp RV P un dineīna vieglo ķēdi saista RV RNP ar saimniekšūnu transporta sistēmu, tādējādi veicinot vīrusa retrogrādo aksonu transportu.[ 48 ],[ 49 ] Tomēr pieaugušu peļu perifēra infekcija parādīja, ka RV P LC8 saistošā domēna dzēšana neliedz vīrusam iekļūt CNS, kas liecina, ka RV proteīns nav tieši iesaistīts RV retrogrādā aksonu izplatībā.[ 50 ]
- Vīrusu elementi, kas kontrolē vīrusu replikāciju
Atšķirībā no daudziem citiem vīrusiem, piemēram, gripas vīrusa, RV patogenitāte ir apgriezti proporcionāla vīrusu RNS sintēzes ātrumam un infekciozo vīrusu daļiņu veidošanās ātrumam. Dažādu himērisku vīrusu saražoto vīrusu mRNS un genoma RNS līmeņu salīdzinājums liecina, ka vīrusu RNS transkripciju un replikāciju regulē vairāki faktori, tostarp RV M, kas ir identificēts kā transaktīvais faktors, kas mediē pāreju no sākotnēji augsta mRNS sintēzes līmeņa uz genoma RNS sintēzi.[ 51 ] Turklāt visu rabdovīrusu M spēj apturēt vīrusu gēnu ekspresiju, saistoties ar RNP, kā rezultātā veidojas ļoti kondensēta mugurkaulam līdzīga struktūra, kas nespēj atbalstīt RNS sintēzi.
Lai identificētu citus vīrusu elementus, kas kontrolē patogenitāti, regulējot vīrusa replikāciju, ļoti patogēnā SB celma 5' terminālās sekvences pakāpeniski tika aizstātas ar sekvencēm no ļoti novājinātā SN vakcīnas celma, kā rezultātā tika iegūti rekombinanti vīrusi SB2 (terminālā sekvence [TS] + L), SB3 (TS + L + pseidogēns [Ψ]), SB4 (TS + L + Ψ + G) un SB5 (TS + L + Ψ + G + M). Intramuskulāra infekcija ar vecāku SB un SN vīrusiem un himēriskajiem RV SB2, SB3, SB4 un SB5 izraisīja augstāko mirstību SB inficētām pelēm un neizraisīja saslimstību vai mirstību SN inficētām pelēm. TS, L un SB aizstāšana ar atbilstošajiem elementiem no SN izraisīja nelielu saslimstības un mirstības samazināšanos, un papildu G vai G plus M apmaiņa ievērojami samazināja vai pilnībā likvidēja vīrusu patogenitāti.
Šo savvaļas tipa un himērisko RV fenotipiskā raksturošana audu kultūrā atklāja, ka dotā RV patogenitāte ir apgriezti proporcionāla tā spējai replikēties neironu šūnās. Lai gan SB replikējās gandrīz 1000 reižu zemākā līmenī nekā SN, un TS, L un SB aizstāšana ar SN līmeņiem maz ietekmēja vīrusa augšanas kinētiku, papildu G vai G plus M aizstāšana SB ar atbilstošajiem SN gēniem izraisīja vīrusa produkcijas pieaugumu par 1 log, kas liecina, ka vīrusa RNS replikācijas kinētiku, kā arī vīrusa daļiņu ražošanu lielā mērā kontrolē RV G proteīns. Šo secinājumu apstiprina dati, kas iegūti ar RV G variantiem, kuru G proteīni atšķiras par vienu aminoskābi. Patogēnais trakumsērgas vīrusa variants SPBNGAK 194 NA šūnās radīja par 1 log zemāku vīrusa titru nekā nepatogēnais variants SPBNGAK 194, un reālā laika PCR analīze parādīja, ka vīrusu RNS transkripcijas un replikācijas ātrums SPBNGAK inficētajās NA šūnās bija 5 un 10 reizes lielāks nekā SPBNGAK inficētajās NA šūnās.[ 52 ] Papildu pierādījumus par apgrieztu korelāciju starp patogenitāti un vīrusu RNS sintēzes un vīrusu daļiņu ražošanas ātrumu sniedza peles, kas inficētas ar himēriskiem rekombinantiem vīrusiem, kuros novājinātā SN celma G un M gēni bija aizstāti ar ļoti patogēnā SB celma gēniem. Šie eksperimenti atklāja vecāku SN celma, kas nes RV G, patogenitātes ievērojamu pieaugumu salīdzinājumā ar patogēno SB celmu. Patogenitāte vēl vairāk palielinājās, kad SN tika ievadīti gan G, gan M no SB.
G vai M vai abu aizvietošana SN gēnā ar atbilstošajiem SB gēniem bija saistīta ar ievērojamu vīrusu daļiņu ražošanas ātruma, kā arī vīrusu RNS sintēzes ātruma samazināšanos. Šie dati liecina, ka gan G, gan M spēlē svarīgu lomu RV patogenezē, regulējot vīrusu replikāciju. Atklājums, ka G vai G plus M aizvietošana SN gēnā ar G vai G plus M no SB izraisa attiecīgi mērenu līdz spēcīgu vīrusu RNS transkripcijas un replikācijas samazināšanos, savukārt tikai M aizvietošana SN gēnā ar M no SB izraisa spēcīgu vīrusu RNS transkripcijas un replikācijas palielināšanos, norāda, ka RV G gēnā ir arī svarīga regulējoša funkcija vīrusu RNS transkripcijā/replikācijā vai nu atsevišķi, vai mijiedarbojoties ar M proteīnu. Mehānisms, ar kuru RV G gēns kontrolē vīrusu RNS sintēzi, nav zināms. Noteiktas nukleotīdu sekvences RV G gēnos, piemēram, tās, kas ietver Arg333 un Lys 194 kodonus, ir identificētas kā šūnu miRNS mērķi. Ir pierādīts, ka mērķa atpazīšana ar šūnu miRNS var izraisīt vīrusu replikācijas pozitīvu vai negatīvu regulāciju. [ 53 ] Arg 333 → Glu 333 vai Lys 194 → Ser 194 aizvietojumi RV G gēna secībā izraisa miRNA mērķa sekvenču atcelšanu, kas savukārt ir saistīts ar ievērojamu vīrusu RNS sintēzes ātruma palielināšanos [Faber M, Tomasa Džefersona Universitāte, Pensilvānija, ASV, nepublicēti dati], kas liecina, ka saimnieka šūnu miRNAs arī spēlē svarīgu lomu RV replikācijas regulēšanā, kā tas ir pierādīts citiem RNS vīrusiem, tostarp vezikulārā stomatīta vīrusam un HCV. [ 54 ], [ 55 ]
Vīrusu replikācijas regulēšana, šķiet, ir viens no svarīgākajiem mehānismiem, kas iesaistīti RV patogenezē. Lai izvairītos no imūnās atbildes reakcijas un saglabātu neironu tīkla integritāti, patogēni RV celmi, bet ne novājināti celmi, var regulēt savu augšanas ātrumu. Zemāks replikācijas ātrums, visticamāk, nāk par labu patogēniem RV celmiem, saglabājot neironu struktūru, ko šie vīrusi izmanto, lai sasniegtu CNS. Vēl viens izskaidrojums patogēnā RV zemākam replikācijas ātrumam ir tāds, ka, lai izvairītos no saimnieka imūnsistēmas agrīnas atklāšanas, vīruss uztur minimālu savu antigēnu ekspresijas līmeni.
Saistība starp RV G ekspresiju, apoptozi un patogenitāti
Ir labi zināms, ka ielu trakumsērgas vīrusa celmi, kas ir ievērojami patogēnāki nekā audu kultūrām adaptēti celmi, ekspresē ļoti ierobežotu G līmeni un neizraisa apoptozi līdz vēlam infekcijas ciklam, kas liecina, ka konkrēta vīrusa celma patogenitāte ir apgriezti proporcionāla RV G ekspresijai un spējai izraisīt apoptozi.[ 56 ] Tieši pierādījumi par korelāciju starp G ekspresijas līmeni un apoptozes apmēru tika iegūti ar rekombinanto RV SPBNGA-GA, kam bija divi identiski G gēni un kas pārmērīgi ekspresēja RV G.[ 57 ] Ar šo rekombinanto RV inficēto neironu kultūru morfoloģiskie pētījumi parādīja, ka šūnu nāve bija ievērojami palielinājusies paralēli RV G pārmērīgai ekspresijai un ka apoptoze ir galvenais mehānisms, kas iesaistīts RV G mediētā nāvē. Jo īpaši F-aktīna iekrāsojuma samazināšanās pēc SPBNGA-GA infekcijas atbilst apoptozes izraisītai aktīna pavedienu depolimerizācijai. Turklāt TUNEL-pozitīvo kodolu skaits SPBNGA-GA inficētajos neironos bija ievērojami palielināts, salīdzinot ar neinficētiem un ar SPBNGA inficētiem neironiem. Tomēr mehānisms, ar kuru RV G gēns mediē apoptozes signalizācijas procesu, joprojām lielākoties nav zināms. Ir izteikts pieņēmums, ka RV G ekspresija virs noteikta sliekšņa nopietni izjauc šūnu membrānu. Ir ļoti iespējams, ka apoptotiskās šūnas netiek ātri izvadītas CNS un tāpēc piedzīvo sekundāru nekrozi. [ 58 ] No otras puses, RV infekcija un jo īpaši RV G proteīna pārekspresija var izraisīt piroptozi – šūnu nāves ceļu, kas līdzīgs apoptozei, kas, atšķirībā no apoptozes, ietver kaspāzes 1 aktivāciju un tādējādi noved pie nekrozes. [ 59 ] RV infekcijas izraisītās nekrozes vai piroptozes pakāpei, visticamāk, ir izšķiroša nozīme pretvīrusu imunitātes indukcijā. Lai gan apoptotiskās šūnas saglabā savu membrānas integritāti un nestimulē iedzimto imūnreakciju, nekrotiskās šūnas kļūst permeabilizētas un izdala endogēnus adjuvantus, kas var izraisīt spēcīgu iedzimto imūnreakciju. [ 60 ]
Tā kā apoptozes/nekrozes līmenis korelē ar RV imunogenitāti, ir ierosināts, ka apoptotisko/nekrotisko šūnu imunostimulējošā iedarbība, visticamāk, veicina aizsargājošas imūnās atbildes veidošanos. Tādēļ RV G ekspresijas regulēšana, visticamāk, ir svarīgs faktors trakumsērgas patogenēzē, jo tā nodrošina līdzekļus patogēnu RV variantu izdzīvošanai un izplatībai nervu sistēmā, neizraisot acīmredzamus neironu bojājumus un neizraisot aizsargājošu imūno atbildi, kas novērstu infekciju.
RV G ekspresiju var regulēt RNS sintēzes līmenī, pēctranslācijas līmenī vai abos līmeņos. Ir pierādīts, ka dažādu RV himērisko variantu ekspresētā RV G līmeņi atspoguļojas vīrusu RNS sintēzes ātrumā, kas liecina, ka RV G ekspresijas atšķirīgā regulācija šajos variantos rodas vīrusu mRNS transkripcijas ātruma variāciju dēļ. Tāpat kā vīrusu RNS transkripcijas ātrumu gadījumā, RV G daudzums, ko ekspresē šie varianti, ir apgriezti proporcionāls vīrusu patogenitātei. No otras puses, primāro neironu kultūru inficēšana ar mazāk patogēno RV variantu CVS-B2c izraisīja četras reizes augstāku G proteīna līmeni nekā inficēšana ar ļoti patogēno CVS-N2c variantu, neskatoties uz salīdzināmu G mRNS sintēzes līmeni abās infekcijās. Impulsa eksperimenti parādīja, ka augstāks G proteīna līmenis ar CVS-B2c inficētajos neironos lielā mērā bija saistīts ar zemāku CVS-B2c G proteīna degradācijas ātrumu salīdzinājumā ar CVS-N2c G proteīnu. Tomēr mehānisms, kas noved pie ātrākas CVS-N2c G proteīna proteolītiskās degradācijas, vēl nav noskaidrots.
Simptomi trakumsērga
Trakumsērgas inkubācijas periods ir vidēji 30–90 dienas. Masīvas infekcijas gadījumā caur lieliem galvas un sejas ievainojumiem to var saīsināt līdz 12 dienām. Retos gadījumos inkubācijas periods var ilgt 1 gadu vai ilgāk.
Pastāv stingri secīgas trīs slimības periodu izmaiņas: prodromāls, ierosmes, paralīze.
Prodromālais periods sākas ar sāpošu vai velkošu sāpju parādīšanos koduma vietā, kā arī sāpēm gar nerviem. Rētas apvidū var būt dedzinoša sajūta, nieze, dažreiz apsārtums un pietūkums. Pacientam ir vispārējs nespēks, galvassāpes, slikta dūša. Tiek atzīmēta vemšana, ķermeņa temperatūras paaugstināšanās līdz 37,5–38 °C un progresējošu garīgo traucējumu simptomi: paaugstināta refleksu uzbudināmība, neizskaidrojama trauksmes sajūta, bailes, melanholija. Bieži vien pacients ir nomākts, kavēts, noslēgts, atsakās ēst, slikti guļ, sūdzas par drūmām domām, biedējošiem sapņiem. Prodromālais periods ilgst 2–3 dienas, dažreiz pagarinās līdz 7 dienām. Šī perioda beigās var būt trauksmes lēkmes ar īslaicīgām elpošanas grūtībām, spiediena sajūtu krūtīs, ko pavada tahikardija un paātrināta elpošana.
Uzbudinājuma periodu raksturo hidrofobijas parādīšanās: mēģinot dzert, bet pēc tam, ieraugot ūdeni vai atgādinot par to, pacientam rodas rīkles un balsenes konvulsīvas spazmas, kuru laikā viņš ar kliedzienu izmet ūdens krūzi, trīcošam rokām atmet uz priekšu, atmet galvu un ķermeni. Kakls ir izstiepts, seju izkropļo sāpīga grimase, kas elpošanas muskuļu spazmas dēļ kļūst zilgana. Acis izspiežas, pauž bailes, lūdzas pēc palīdzības, zīlītes ir paplašinātas, ieelpošana ir apgrūtināta. Lēkmes kulminācijā iespējama sirdsdarbības un elpošanas apstāšanās. Lēkme ilgst vairākas sekundes, pēc kuras pacienta stāvoklis, šķiet, uzlabojas. Pēc tam balsenes un rīkles muskuļu spazmu lēkmes var rasties pat no gaisa kustības (aerofobija), spilgtas gaismas (fotofobija) vai skaļa vārda (akustofobija). Lēkmes pavada psihomotoriska uzbudinājums, kura laikā pacients uzvedas kā "trakais". Lēkmes laikā apziņa ir apmiglota, bet starplēkmju periodā tā noskaidrojas. Uzbudinājuma periodā, simpātiskās nervu sistēmas paaugstinātā tonusa dēļ, pacientiem strauji palielinās siekalošanās (sialoreja) ar nespēju norīt siekalas rīkles muskuļu spazmas dēļ. Pacients izsmidzina siekalas. Dažiem pacientiem var attīstīties meningisma un pat opistotonusa pazīmes, un bieži ir krampji. Šajā gadījumā cerebrospinālais šķidrums var nemainīties, bet dažiem pacientiem olbaltumvielu koncentrācija var palielināties un šūnu skaits palielināties limfocītu dēļ.
Bez atbilstošas ārstēšanas pastiprinās dehidratācijas pazīmes, sejas vaibsti kļūst asāki un samazinās ķermeņa svars. Ķermeņa temperatūra paaugstinās līdz augstām vērtībām. Iespējami krampji. Uzbudinājuma stadijas ilgums ir aptuveni 2–3 dienas, reti 4–5 dienas. Nāvējoša iznākuma parasti iestājas viena no lēkmēm laikā. Reti pacients izdzīvo līdz slimības trešajai stadijai.
Paralīzes periodā pacients nomierinās. Hidrofobijas lēkmes izzūd, pacients var dzert un norīt ēdienu, apziņa ir skaidra. Tomēr, neskatoties uz šķietamo labsajūtu, drīz parādās letarģija, apātija, depresija, ekstremitāšu paralīze, iegurņa traucējumi, galvaskausa nervu paralīze. Ķermeņa temperatūra paaugstinās līdz 42–43 °C, pazeminās arteriālais spiediens, un pirmās dienas beigās iestājas nāve no sirds un asinsvadu un elpošanas centru paralīzes.
Perifērajās asinīs novēro neitrofīlu leikocitozi, paaugstinātu hemoglobīna, eritrocītu un hematokrīta līmeni.
Kas tevi traucē?
Veidlapas
Klīniski izšķir tipiskās un atipiskās formas. Atipiskās formas ietver visus gadījumus bez uzbudinājuma un hidrofobijas. Atipiskās formas ir bulbārā, cerebellārā, meningoencefalītiskā utt.
Diagnostika trakumsērga
Trakumsērgas antigēna, antivielu, vīrusa RNS vai vīrusa izolēšanas noteikšana ļauj diagnosticēt trakumsērgu. Tā kā jebkurš atsevišķs tests pacientam ar trakumsērgu var būt negatīvs, dažreiz ir nepieciešami vairāki seruma paraugi trakumsērgas antivielu noteikšanai, siekalu paraugi vīrusa kultūrai un ādas biopsija tiešai imunofluorescences pārbaudei vīrusa antigēna noteikšanai, īpaši, ja ir nopietnas aizdomas par trakumsērgu.
Viena no ātrākajām metodēm trakumsērgas diagnosticēšanai cilvēkiem pirms nāves ir tieša imunofluorescences testa veikšana kakla pamatnes ādas biopsijā, lai noteiktu trakumsērgas antigēnu. Tiešā imunofluorescences tests ir visjutīgākā un specifiskākā metode trakumsērgas antigēna noteikšanai ādā un citos svaigos audos (piemēram, smadzeņu biopsijā), lai gan slimības sākumā rezultāti dažkārt var būt negatīvi. Ja svaigi audi nav pieejami, fiksēto audu fermentatīva gremošana var palielināt imunofluorescences testa reaktivitāti; tomēr jutība var būt nepieņemami zema.
Diagnozi var noteikt arī tad, ja vīruss tiek izolēts no siekalām pēc neiroblastomas šūnu vai laboratorijas grauzēju inokulācijas; tas parasti ir visefektīvākais slimības pirmajās 2–3 nedēļās. Diagnostiska ir arī trakumsērgas vīrusu neitralizējošo antivielu noteikšana nevakcinētu personu serumā, ko parasti veic ar ātro fluorescējošā fokusa inhibīcijas testu (RFFIT). Antivielu klātbūtne cerebrospinālajā šķidrumā apstiprina diagnozi, taču tās var parādīties 2–3 dienas vēlāk nekā seruma antivielas, un tāpēc slimības sākumposmā tās var būt mazāk noderīgas. Lai gan seroloģiskā atbilde pēc vakcinācijas parasti neatšķiras no slimības izraisītās seroloģiskās atbildes, vakcinācija parasti neražo antivielas pret cerebrospinālo šķidrumu.
Pēdējo 25 gadu laikā ir labi dokumentēti tikai septiņi trakumsērgas "atveseļošanās" gadījumi. Lai gan trakumsērgas vīruss netika izolēts ne no viena no pacientiem, augsts trakumsērgu neitralizējošo antivielu titrs seruma paraugos un neitralizējošo antivielu klātbūtne cerebrospinālajā šķidrumā spēcīgi apstiprināja diagnozi.
Kas ir jāpārbauda?
Kādi testi ir vajadzīgi?
Diferenciālā diagnoze
Cilvēka trakumsērgas diagnoze parasti tiek noteikta, pamatojoties uz epidemioloģiskajiem un klīniskajiem datiem, un tā tiek apstiprināta laboratorijā. Diagnoze ir vienkārša, ja ir bijuši dzīvnieku kodumi un ir novērots viss simptomu un pazīmju spektrs. Pretējā gadījumā pirms specifisku laboratorisko testu veikšanas ir nepieciešama rūpīga, bet ātra mazāk tipisku gadījumu epidemioloģisko un klīnisko pazīmju izvērtēšana. Jebkuram pacientam ar neiroloģiskām pazīmēm vai simptomiem vai neizskaidrojamu encefalītu jājautā par iespējamu saskari ar dzīvniekiem trakumsērgas endēmiskajos apgabalos dzīvesvietas valstī vai ārpus tās. Trakumsērgas neesamība vairākos nesenos cilvēku nāves gadījumos Amerikas Savienotajās Valstīs, iespējams, ir saistīta ar rūpīgas saskares anamnēzes trūkumu.
Slimības sākumā trakumsērga var atdarināt daudzas infekcijas un neinfekcijas slimības. Daudzas citas encefalīta formas, piemēram, herpesvīrusu un arbovīrusu izraisītas, atgādina trakumsērgu. Arī citas infekcijas slimības var atdarināt trakumsērgu, piemēram, stingumkrampji, smadzeņu malārija, riketsioze un vēdertīfs. Paralītiskās infekcijas slimības, kuras var sajaukt ar trakumsērgu, ir poliomielīts, botulisms un herpes simian B encefalīts.
Neinfekciozas slimības, kuras var sajaukt ar trakumsērgu, ir vairāki neiroloģiski sindromi, īpaši akūta iekaisīga polineiropātija (Gijēna-Barē sindroms), kā arī alerģisks pēcvakcinācijas encefalomielīts, kas rodas sekundāri nervu audu trakumsērgas vakcinācijas rezultātā, saindēšanās vai narkotiku intoksikācijas, alkohola lietošanas pārtraukšanas sindroma, akūtas porfīrijas un trakumsērgas histērijas dēļ. Gijēna-Barē sindromu var sajaukt ar paralītisku trakumsērgu un otrādi.
Kurš sazināties?
Profilakse
Pastēra izstrādātā pirmā trakumsērgas vakcīna 1885. gadā ievadīja daudz efektīvākas trakumsērgas kontroles ēru. Mūsdienās, neskatoties uz gandrīz 100% cilvēku mirstību no trakumsērgas, slimība ir pilnībā novēršama, veicot vakcināciju pirms un/vai pēc saskares ar inficēšanās gadījumu. Lai gan Pastērs un viņa kolēģi uzsāka privāto suņu vakcināciju Parīzē, pirmā masveida suņu vakcinācija tika veikta 20. gadsimta 20. gadu sākumā Japānā, iezīmējot pirmo nozīmīgo valsts mēroga trakumsērgas kontroles programmu. Savvaļas dzīvnieku perorālā vakcinācija, kas pirmo reizi tika izstrādāta 20. gadsimta 70. gados, kopš tā laika ir atkārtoti pierādīta kā efektīva slimības kontroles metode galvenajiem sauszemes saimniekiem, piemēram, lapsām, jenotiem un skunksiem.[ 68 ] Ilgstoša rezervuāra dzīvnieku populāciju vakcinācija pret trakumsērgu ar 70% vai augstāku aptveres līmeni galu galā iznīcinās RABV no rezervuāra sugām un novērsīs vīrusa izplatīšanos nejaušiem saimniekiem.[ 69 ]
Filoģenētiskie dati liecina, ka lisāvīrusi inficēja sikspārņus ilgi pirms tie inficēja sauszemes zīdītājus, un lielākā daļa lisāvīrusu, tostarp RABV, joprojām cirkulē dažādu sikspārņu sugu vidū visā pasaulē.[ 70 ] Tomēr efektīvas metodes RABV pārnešanas novēršanai starp sikspārņiem joprojām nav pieejamas, kas šobrīd izslēdz iespēju pilnībā izskaust trakumsērgu. Tomēr pat pēc saskares ar RABV, ko izraisījis ar trakumsērgu inficēts zīdītājs, droša un efektīva profilakse pēc saskares (PEP, tostarp brūču tīrīšana, trakumsērgas imūnglobulīns un vakcinācija pret trakumsērgu) var pasargāt cilvēkus no trakumsērgas infekcijas, ja ārstēšana tiek veikta nekavējoties un saskaņā ar Pasaules Veselības organizācijas (PVO) ieteikumiem.
Šīs divas cilvēku nāves novēršanas metodes — viena, kuras pamatā ir inficēto cilvēku vakcinācija, un otra, kuras pamatā ir pietiekama skaita suņu vakcinācija, lai pārtrauktu pārnešanas ciklu tā avotā, — ir "vienas veselības" pieejas pamatelementi suņu trakumsērgas profilaksei un kontrolei. Šie divi dažādie cilvēku nāves novēršanas līdzekļi tika apsvērti kā atsevišķas alternatīvas: A stratēģija, kuras pamatā ir PEP nodrošināšana cilvēkiem, un B stratēģija, kuras pamatā ir suņu vakcinācija; vai kā kombinētas A + B stratēģijas sastāvdaļas, analizējot alternatīvo stratēģiju iespējamās izmaksas.[ 71 ]
Tādas valstis kā Taizeme ir guvušas milzīgus panākumus cilvēku nāves gadījumu novēršanā, izmantojot PEP, taču ir arī konstatējušas pieaugošu pieprasījumu un ar PEP lietošanu saistītās izmaksas. [ 72 ] Piemēram, salīdzinot ar situāciju 1991. gadā, 2003. gadā PEP bija nepieciešams četras reizes vairāk cilvēku (vairāk nekā 400 000). Jaunākie dati liecina, ka Ķīnas Tautas Republika, kas katru gadu vakcinē 15 miljonus cilvēku pēc iespējamas saskares ar trakumsērgu, PEP vien tērē aptuveni 650 miljonus ASV dolāru gadā. [ 73 ]
Daudz ilgtspējīgāka pieeja ir novērst infekcijas izplatīšanos tās izcelsmes vietā, dzīvnieku populācijā, vienlaikus palielinot PEP pieejamību cilvēkiem, kas bijuši pakļauti vīrusam, kad tas nepieciešams. Ja ir politiskā griba un atbilstošs finansējums suņu trakumsērgas kontrolei, nāves gadījumus var un ir izskauduši. Plaša suņu vakcinācijas izmantošana ir novedusi pie suņu trakumsērgas izskaušanas vairākās valstīs, tostarp Malaizijā 1954. gadā [ 74 ], Japānā 1956. gadā, Taivānā 1961. gadā, Singapūrā un jo īpaši visā Rietumeiropā (pārskats sniegts Rupprecht et al., King et al., un Gongal un Wright darbos). [ 75 ]


 [
[