
Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Restenoze
Raksta medicīnas eksperts
Pēdējā pārskatīšana: 04.07.2025
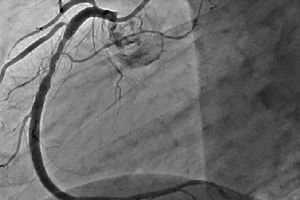
Restenoze ir atkārtotas sašaurināšanās par 50% vai vairāk perkutānas koronāras intervences vietā. Restenozi parasti pavada atkārtota stenokardija, kuras dēļ bieži vien nepieciešamas atkārtotas intervences. Attīstoties PCI, restenozes biežums ir samazinājies, un mainījusies arī tās daba.
Restenoze pēc transluminālas balona koronārās angioplastikas (TBCA)
Pēc TBCA restenozes biežums pirmajos 6 mēnešos ir 30–40%. Tās galvenais attīstības mehānisms ir lokāla negatīva asinsvada remodelācija, kas būtībā ir artērijas lūmena elastīga sabrukšana, ko procedūras laikā paplašina balons. Relatīvu lomu spēlē arī lokāla trombu veidošanās un neointimāla augšana. Pastāv klīniski (2. tipa cukura diabēts, akūts koronārais sindroms (AKS), restenozes anamnēze), angiogrāfiski (LAD bojājums, mazs asinsvada diametrs, hroniska pilnīga nosprostojums (CTO), garš bojājums, deģenerētas venozās šuntēšanas operācijas) un procedūras (liela atlikušā stenoze, neliels asinsvada diametra palielinājums balona piepūšanas rezultātā) restenozes riska faktori pēc TBCA. Restenozes gadījumā parasti tiek veikta atkārtota intervence. Atkārtotas TBCA panākumi restenozes vietā ir salīdzināmi ar pirmo procedūru. Tomēr ar katru nākamo TBCA restenozes gadījumā atkārtotas restenozes risks ievērojami palielinās. Pēc 3. mēģinājuma tas sasniedz 50–53%. Turklāt ar katru atkārtotu TBCA attīstošā restenoze ir izteiktāka nekā pirmā. Restenozes riska faktori pēc otrās TBCA ir pirmās restenozes agrīna parādīšanās (60–90 dienas pēc procedūras), LAD bojājumi, daudzu asinsvadu bojājumi, 2. tipa cukura diabēts, arteriāla hipertensija, nestabila stenokardija un vairākkārtēja balonu piepūšana pirmās procedūras laikā. Ņemot vērā restenozes augsto biežumu un tās attīstības mehānismu, klīniskajā praksē tika ieviesti koronārie stenti, kuriem teorētiski vajadzēja novērst negatīvu asinsvadu remodelāciju pēc TBCA.
Pirmie pētījumi, kas pierādīja stentēšanas efektivitāti, bija STRESS un BENESTENT pētījumi, kas publicēti 1993. gadā. BENESTENT pētījumā piedalījās 516 pacienti ar nesen diagnosticētu koronāro artēriju stenozi, kuras diametrs pārsniedz 3 mm, un viņi tika nejaušināti iedalīti divās grupās: parastā TBCA (n = 257) un TBCA ar stenta ievietošanu (n = 259). Pēc 3 gadiem restenozes biežums angiogrāfijas laikā bija 32% parastās TBCA grupā un 22% stentēšanas grupā. Relatīvais restenozes biežuma samazinājums bija 31% (p < 0,01). Stentēšanas grupai bija arī mazāka nepieciešamība pēc atkārtotas miokarda revaskularizācijas (10 pret 20,6% parastās TBCA grupā; p < 0,01), kas bija saistīts ar mazāku stentēšanas recidīva biežumu stentēšanas grupā.
Saskaņā ar STRESS pētījumu (n = 407), restenozes biežums stentēšanas grupā (n ~ 205) bija arī zemāks nekā konvencionālās PTKA grupā (n = 202) - 31,6 pret 42,1% (p < 0,01). Stentu izmantošanas priekšrocība salīdzinājumā ar konvencionālo angioplastiju restenozes gadījumā PTKA vietā tika pierādīta REST pētījumā, kurā 383 pacienti ar restenozi tika nejaušināti iedalīti stentēšanas vai atkārtotas perkutānas transluminālas koronāras angioplastijas grupā. Angiogrāfiski atklāta atkārtota restenoze stentēšanas grupā bija par 18% zemāka (18 pret 5,32%; p < 0,03). Atkārtota miokarda revaskularizācija, kas ir klīniski nozīmīgas restenozes indikators, arī bija nepieciešama ievērojami retāk pacientu grupā, kuriem tika veikta stentēšana (10 pret 27%; p < 0,001). Tādējādi labāki rezultāti, izmantojot stentus, tika pierādīti ne tikai vietējās artērijās, bet arī intervences gadījumā restenozes gadījumā, kas attīstījās pēc TBCA.
Restenoze pēc tukša stenta implantācijas (BSI)
Lai gan nesegti koronārie stenti ir samazinājuši restenozes biežumu par 30–40 % salīdzinājumā ar TBCA, 17–32 % pacientu attīstās stenta restenoze pat pēc stenta ievietošanas, kam nepieciešama atkārtota revaskularizācija. Stenta stenozes (ISS) attīstības mehānisms atšķiras no TBCA mehānisma. Pēc stenta ievietošanas galvenais restenozes veicinātājs ir neointima veidošanās, nevis negatīva remodelācija, kā tas ir TBCA gadījumā, kuras stenta implantācijas vietā praktiski nav. Neointima veidojas gludo muskuļu šūnu migrācijas un proliferācijas rezultātā, kas rada ārpusšūnu matricu, kas kopā ar šūnām veido neointima. Turklāt tromba noturība stenta ievietošanas vietā ir svarīga arī pacientiem ar diabētu.
Stenta iekšējās stenozes (ISS) galvenā klasifikācija ir Mehran piedāvātā klasifikācija, kas ietver četrus veidus atkarībā no bojājuma apjoma un smaguma pakāpes: I veida ISS — lokāla (< 10 mm garumā), II veida — difūza (> 10 mm garumā), III veida — proliferatīva (> 10 mm un sniedzas ārpus stenta) un IV veida — ISS, kas noved pie nosprostošanās. Pirmais veids ir iedalīts apakštipos atkarībā no atrašanās vietas stentā: 1a — uz līkuma vai starp stentiem, 1b — margināla, 1c — stenta iekšpusē, 1d — multifokāla.
VRS attīstības riska faktori ir iejaukšanās venozo šuntu operācijās, hroniskas nosprostošanās, ostiālu bojājumi, mazs asinsvada diametrs, atlikušās stenozes klātbūtne, stenta ievietošana VRS gadījumā, mazs asinsvada diametrs pēc procedūras, LAD bojājums, garš stenta garums, diabēta klātbūtne, vairāku stentu implantācija vienā bojājumā. Pastāv norādes par ģenētisko faktoru ietekmi, jo īpaši glikoproteīna IIIa gēna polimorfismu un metilēntetrahidrofolāta reduktāzes gēna - gēna, kas kodē interleikīnu-1, mutācijām. Margināla stenta restenozes attīstības gadījumā galvenais riska faktors ir izteikts aterosklerotisks bojājums stentētajā segmentā.
Restenoze galvenokārt rodas pirmo 6–8 mēnešu laikā pēc perkutānas koronāras intervences. Lielākajai daļai pacientu klīniskie simptomi attīstās aptuveni vienlaikus. VRS parasti izpaužas kā atkārtota stenokardija. Nestabila stenokardija rodas retāk (11–41 % gadījumu). AMI attīstās 1–6 % pacientu. Tādējādi visbiežākais stenokardijas cēlonis 1–6 mēnešu laikā pēc stenta ievietošanas ir VRS attīstība, kas parasti prasa atkārtotu revaskularizāciju. VRS ārstēšanai ir vairākas metodes. Var veikt konvencionālu TBCA, kas noved pie tālākas stenta paplašināšanas (56 % ieguldījums asinsvada diametra galīgajā palielinājumā) un izstumj neointimu caur stenta šūnām (44 % ieguldījums diametra galīgajā palielinājumā). Tomēr vairumā gadījumu intervences vietā novērojama atlikušā restenoze (vidēji 18 %). Turklāt pēc TBCA atkārtota revaskularizācija ir nepieciešama 11 % gadījumu, biežāk pacientiem ar daudzvadu slimību, zemu KKIF, venozās šuntēšanas transplantātu intervences gadījumā vai agrīna pirmā VRS parādīšanās gadījumā. Atkārtotas VRS attīstības risks pēc TBCA ir atkarīgs arī no bojājuma veida un svārstās no 10% lokālas restenozes gadījumā līdz 80% intrastenta nosprostošanās gadījumā. LES implantācija VRS vietā nesamazina tā atkārtošanās risku, salīdzinot ar TBCA vienu pašu.
Otra VRS ārstēšanas metode ir brahiterapija, kas ietver radioaktīvā avota ievadīšanu koronāro artērijas lūmenā, novēršot gludo muskuļu šūnu proliferāciju un attiecīgi samazinot restenozes risku. Tomēr augstās iekārtu izmaksas, procedūras tehniskā sarežģītība un vēlīnās stenta trombozes (LT) biežuma pieaugums gandrīz pilnībā ir izslēdzis brahiterapiju no klīniskās izmantošanas.
Revolucionārs brīdis VRS ārstēšanā bija zāles eluējošu stentu ieviešana. Salīdzinot ar LES vietējās artērijās, tie samazina VRS risku par 70–80%. Pirmie dati par DES efektivitāti pacientiem ar jau attīstītu VRS tika iegūti TAXUS III pacientu reģistrā, kurā, lietojot SPG1 šādiem pacientiem, VRS recidīva biežums pēc 6 mēnešiem bija tikai 16%, kas ir zemāks nekā iepriekš minētajos pētījumos ar TBCA. TRUE reģistrā, kurā bija iekļauti pacienti pēc SES implantācijas LES restenozes gadījumā, pēc 9 mēnešiem atkārtota revaskularizācija bija nepieciešama mazāk nekā 5% pacientu, galvenokārt ar cukura diabētu un AKS. TROPICAL pētījumā tika salīdzināts atkārtotas restenozes biežums pacientiem pēc DES implantācijas restenozes vietā ar GAMMA I un GAMMA II pētījumu datiem, kuros kā ārstēšanas metode tika izmantota brahiterapija. Pēc 6 mēnešiem atkārtotas restenozes sastopamība SPS grupā bija ievērojami zemāka (9,7 pret 40,3%; p < 0,0001). Svarīgi atzīmēt, ka arī stenta trombozes un miokarda infarkta sastopamība SPS grupā bija zemāka (TS 0,6 pret 3,9%; p = 0,08; MI - 1,8 pret 9,4%; p = 0,004). SPS priekšrocība salīdzinājumā ar brahiterapiju tika apstiprināta randomizētā SISR pētījumā, kurā 384 pacienti ar attīstītu VRS NSC tika nejaušināti iedalīti brahiterapijas vai SPS implantācijas grupās. Pēc 9 mēnešiem atkārtotas revaskularizācijas nepieciešamība pēc brahiterapijas bija lielāka (19,2%) nekā SPS implantācijas grupā (8,5%), kas atspoguļoja biežāku restenozes atkārtošanos. Pēc 3 gadiem SPS priekšrocība atkārtotas revaskularizācijas nepieciešamības samazināšanā atkārtotas stenta restenozes dēļ saglabājās (19 pret 28,4%). Trombozes biežumā starp grupām nebija būtiskas atšķirības.
Galvenie faktori recidivējošas VRS attīstībai pacientiem ar LES SPS implantācijas gadījumā ir mazs asinsvada diametrs (< 2,5 mm), difūzs restenozes veids un hroniskas nieru mazspējas klātbūtne, kurai nepieciešama hemodialīze. Randomizētā pētījumā TAXUS V ISR SPS arī uzrādīja augstu efektivitāti VRS ārstēšanā, samazinot recidivējošas restenozes biežumu par 54% salīdzinājumā ar brahiterapiju.
Tika veikti arī randomizēti pētījumi, kuros salīdzināja TBCA efektivitāti VRS un DES implantācijā. Randomizētā RIBS-II pētījumā pēc 9 mēnešiem atkārtota restenoze pēc DES implantācijas bija par 72% retāk sastopama nekā pēc TBCA, kas samazināja nepieciešamību pēc atkārtotas revaskularizācijas no 30 līdz 11%. ISAR DESIRE pētījumā salīdzināja TBCA efektivitāti VRS ar SPP vai SPS implantāciju. Pēc 6 mēnešiem izrādījās, ka abi DES bija efektīvāki atkārtotas restenozes novēršanā nekā TBCA (tās sastopamība bija 44,6% ar TBCA, 14,3% SPS grupā un 21,7% SPS grupā), kas samazināja nepieciešamību pēc atkārtotas revaskularizācijas. Tiešā SPP un SPS salīdzinājumā tika konstatēts, ka SPS ievērojami efektīvāk samazināja nepieciešamību pēc atkārtotas revaskularizācijas nekā SPP (8 pret 19%). Tādējādi DES implantācija samazina atkārtotas LES VRS sastopamību, salīdzinot gan ar TBCA, gan brahiterapiju, kas samazina atkārtotu PCI skaitu un tādēļ padara to implantāciju par izvēles procedūru šādiem pacientiem.
Restenoze pēc zāļu eluējošā stenta (DES) implantācijas
Neskatoties uz stenta stenozes sastopamības samazināšanos par 70–80 %, lietojot DES, salīdzinot ar LES, viņi nevarēja pilnībā izslēgt šīs jatrogēnās stenta ievietošanas sekas. Tās kopējā sastopamība vidēji saglabājas mazāka par 10 %. Papildus restenozes sastopamības kvantitatīvajam samazinājumam viņi arī būtiski mainīja notiekošās restenozes veidu. Tādējādi pēc DES implantācijas restenoze parasti ir fokāla. Klīniski, tāpat kā LES gadījumā, tā visbiežāk izpaužas kā stabilas stenokardijas recidīvs (77 %), retāk (8 %) tā ir asimptomātiska. 5 % gadījumu tā izpaužas kā nestabila stenokardija, un 10 % tās pirmais simptoms ir miokarda infarkts bez Q viļņa. Galvenie faktori DES restenozes attīstībā ir 2. tipa cukura diametra diametrs, mazs asinsvada diametrs un bojājuma apjoms. Nav skaidru ieteikumu šādu pacientu ārstēšanai. Alternatīvas iespējas ir DES atkārtota implantācija (tā paša vai cita veida), TBCA vai brahiterapija. Vidējais atkārtotas restenozes rādītājs pēc otrās DES ir 24%, un tas ir vienāds neatkarīgi no tā, vai tiek implantēts viena veida DES vai cita veida DES.


 [
[