
Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Parastie spontānie aborti - cēloņi
Raksta medicīnas eksperts
Pēdējā pārskatīšana: 04.07.2025
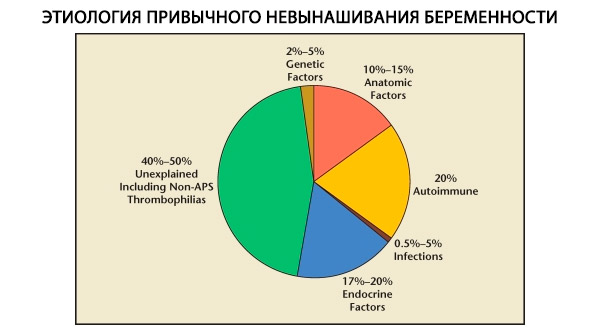
Ieraduma grūtniecības spontāno abortu struktūrā izšķir ģenētiskos, anatomiskos, endokrīnos, imunoloģiskos un infekcijas faktorus. Izslēdzot visus iepriekš minētos cēloņus, paliek pacientu grupa, kuriem ieraduma spontānā aborta izcelsme nav skaidra (idiopātiski spontānie aborti). Saskaņā ar C. Coulam et al. (1996) datiem, 80% idiopātisko spontāno abortu pamatā ir neatpazīti imūnsistēmas traucējumi.
Nav pārliecinošu pierādījumu tam, ka endometrioze izraisa atkārtotus spontānos abortus vai ka endometriozes medikamentoza vai ķirurģiska ārstēšana samazina atkārtotu spontāno abortu biežumu.
Saskaņā ar pašreizējiem konceptiem, papildus ģenētiskiem un daļēji infekcioziem cēloņiem, kas noved pie patoloģiska embrija veidošanās, citu faktoru (anatomisko, endokrīno, imunoloģisko) kaitīgās ietekmes īstenošana sastāv no nelabvēlīga fona radīšanas ģenētiski pilnīgas apaugļotas olšūnas attīstībai, kas noved pie horiona rezerves jaudas izsīkuma un attīstības pārtraukšanas (embriogenēzes). Kritiskie periodi grūtniecības pirmajā trimestrī tiek atzīti par 6-8 nedēļām (embrija nāve) un 10-12 nedēļām (apaugļotas olšūnas izraidīšana).
 [ 1 ]
[ 1 ]
Ģenētiski ierasta spontāna aborta cēloņi
Ģenētiskie faktori veido 3–6% no ierastā spontānā aborta cēloņiem. Sporādiskas grūtniecības pārtraukšanas gadījumā pirmajā trimestrī aptuveni 50% abortu ir hromosomu anomālijas. Lielākā daļa no tām (95%) ir hromosomu skaita izmaiņas - monosomija (vienas hromosomas zudums), trisomija (papildu hromosomas klātbūtne), kas rodas mejozes kļūdu rezultātā, kā arī poliploīdija (hromosomu sastāva palielināšanās ar pilnu haploīdu komplektu), kas rodas, ja olšūnu apaugļo divi vai vairāki spermatozoīdi. Sporādiskos spontānos abortos visbiežāk sastopama trisomija - 60% no visām mutācijām (visbiežāk 16. hromosomā, kā arī 13., 18., 21., 22. hromosomā), otrajā vietā pēc biežuma ir Šereševska-Tērnera sindroms (45. hromosoma X0) - 20%, atlikušos 15% veido poliploīdija (īpaši triploīdija).
Ja aborta laikā mainās hromosomu skaits, vecāku kariotipa izmeklēšana visbiežāk neatklāj nekādu patoloģiju, un augļa hromosomu slimības varbūtība nākamās grūtniecības laikā ir 1%. Turpretī, pārbaudot abortus pāriem ar ieraduma spontāno abortu, 3–6% gadījumu tiek novērotas strukturālas hromosomu izmaiņas (intrahromosomālas un starphromosomālas). Pārbaudot vecāku kariotipu, 7% gadījumu tiek konstatētas līdzsvarotas hromosomu pārkārtošanās. Visbiežāk tās ir reciprokās translokācijas, kurās vienas hromosomas segments atrodas cita nehomologas hromosomas segmenta vietā, kā arī dzimumhromosomu mozaīcisms, inversija un hromosomu atklāšana gredzena formā. Šādu pārkārtojumu klātbūtnē vienam no laulātajiem mejozes laikā tiek kavēti hromosomu pārošanās un atdalīšanās procesi, kā rezultātā gametās tiek zaudētas (dzēstas) vai dubultotas (dublētas) hromosomu sekcijas. Tas izraisa tā sauktās nelīdzsvarotās hromosomu pārkārtošanās, kurās embrijs vai nu nav dzīvotspējīgs, vai arī ir smagas hromosomu patoloģijas nesējs. Varbūtība, ka bērnam piedzims nelīdzsvarotas hromosomu anomālijas, ja viena no vecākiem kariotipā ir līdzsvarotas hromosomu pārkārtošanās, ir 1–15%. Datu atšķirības ir saistītas ar pārkārtojumu raksturu, iesaistīto segmentu lielumu, nesēja dzimumu un ģimenes anamnēzi.
Diagnostika
Anamnēze
- Iedzimtas slimības ģimenes locekļos.
- Iedzimtu anomāliju klātbūtne ģimenē.
- Bērnu ar garīgu atpalicību dzimšana.
- Neauglības un/vai nezināmas izcelsmes spontāna aborta klātbūtne precētam pārim vai radiniekiem.
- Neskaidri perinatālās mirstības gadījumi.
Īpašas pētījumu metodes
- Vecāku kariotipa izpēte ir īpaši indicēta precētiem pāriem jaundzimušā piedzimšanas gadījumā ar attīstības defektiem papildus spontānā aborta anamnēzē, kā arī ieraduma spontānā aborta gadījumos grūtniecības sākumposmā.
- Aborta citogēnētiskā analīze nedzīvi dzimuša bērna vai jaundzimušo mirstības gadījumos.
Indikācijas konsultācijai ar citiem speciālistiem
Ja vecākiem tiek konstatētas izmaiņas kariotipā, nepieciešama ģenētiķa konsultācija, lai novērtētu bērna ar patoloģiju piedzimšanas riska pakāpi vai, ja nepieciešams, lai izlemtu par olšūnas vai spermas ziedošanas jautājumu.
Pacienta turpmākā aprūpe
Ja precētam pārim ir patoloģisks kariotips, pat vienam no vecākiem, grūtniecības laikā ieteicams veikt pirmsdzemdību diagnostiku - horiona biopsiju vai amniocentēzi -, jo auglim ir augsts attīstības traucējumu risks.
Anatomiski ierasta aborta cēloņi
Anatomiski iemesli parastam abortam ir šādi:
- iedzimtas dzemdes attīstības anomālijas (pilnīga dzemdes dubultošanās; divragaina, seglu formas, vienragaina dzemde; daļēja vai pilnīga intrauterīna starpsiena);
- iegūti anatomiski defekti;
- intrauterīnās saaugumi (Ašermana sindroms);
- submukozas dzemdes fibroīdi;
- isthmic-cervikālā nepietiekamība.
Anatomisko anomāliju biežums pacientēm ar ieraduma spontāno abortu svārstās no 10 līdz 16 %. Dzemdes malformāciju, kas var izraisīt spontāno abortu (bet ne neauglību), rašanās biežums attiecībā pret visām dzemdes malformācijām ir šāds: divragaina dzemde — 37 %, seglu formas dzemde — 15 %, intrauterīnā starpsiena — 22 %, pilnīga dzemdes dubultošanās — 11 %, vienraga formas dzemde — 4,4 %.
Parastā aborta diagnoze
Anamnēze
Dzemdes anatomiskās patoloģijas gadījumā biežāk novēro vēlu grūtniecības pārtraukšanu un priekšlaicīgas dzemdības, tomēr, implantējot uz intrauterīnās starpsienas vai miomatozā mezgla tuvumā, ir iespējama arī agrīna grūtniecības pārtraukšana.
Isthmi-dzemdes kakla nepietiekamības gadījumā patognomoniska pazīme ir spontāna grūtniecības pārtraukšana otrajā trimestrī vai priekšlaicīgas priekšlaicīgas dzemdības, kas notiek relatīvi ātri un ar nelielām sāpēm.
Dzemdes malformāciju gadījumā jāpievērš uzmanība anamnētiskām urīnceļu patoloģijas pazīmēm (bieži vien pavada iedzimtas dzemdes anomālijas) un menstruālās funkcijas attīstības raksturam (hematometra pazīmēm ar funkcionējošu rudimentāru dzemdes ragu).
Īpašas pārbaudes metodes
- Pašlaik diagnozes noteikšanai tiek veikta histerosalpingogrāfija, kas ļauj izpētīt dzemdes dobuma formu, noteikt submukozu miomu, saaugumu, starpsienu klātbūtni un noteikt olvadu caurlaidību. Lai diagnosticētu dzemdes patoloģiju, ir racionāli veikt histerosalpingogrāfiju periodā starp menstruācijām un ovulāciju, t.i., menstruālā cikla pirmajā fāzē pēc asiņainas izdalīšanās pārtraukšanas (cikla 7.–9. diena). Lai diagnosticētu istmiski-dzemdes kakla nepietiekamību, pētījums tiek veikts menstruālā cikla otrajā fāzē (18.–20. diena), lai noteiktu dzemdes kakla iekšējo atveru stāvokli. Pirms histerosalpingogrāfijas veikšanas ir jāizslēdz iegurņa orgānu iekaisuma slimības vai jāārstē tās.
- Pēdējos gados histeroskopija ir kļuvusi plaši izplatīta un kļuvusi par zelta standartu intrauterīnās patoloģijas diagnostikā. Tomēr, ņemot vērā tās augstākās izmaksas salīdzinājumā ar histerosalpingogrāfiju, šo metodi izmanto sievietēm ar intrauterīnas patoloģijas indikācijām, pamatojoties uz provizoriskiem ultraskaņas datiem. Ar histeroskopijas palīdzību var izmeklēt dzemdes dobumu, noteikt intrauterīnās patoloģijas raksturu un, ja ir pieejams nepieciešamais aprīkojums (rezektoskops), veikt minimāli invazīvu ķirurģisku ārstēšanu - saaugumu, submukozu miomas mezglu un endometrija polipu noņemšanu. Noņemot intrauterīnu starpsienu, priekšroka tiek dota histerorezektoskopijai ar laparoskopisku kontroli, kas novērš dzemdes sienas perforācijas iespējamību.
- Ultraskaņas izmeklējums tiek veikts menstruālā cikla pirmajā fāzē, kas ļauj veikt prezumptīvu submukozas dzemdes miomas, intrauterīnu saaugumu diagnozi, bet cikla otrajā fāzē - identificēt intrauterīnu starpsienu un divragainu dzemdi. Šī metode ir īpaši svarīga grūtniecības sākumposmā, kad tās jutība šo stāvokļu diagnosticēšanā ir 100%, bet specifiskums - 80%. Ārpus grūtniecības diagnozei nepieciešams papildu apstiprinājums ar citām metodēm.
- Ārvalstu autori norāda uz sonohistērogrāfijas (ultraskaņas izmeklēšana, izmantojot transvaginālu sensoru ar iepriekšēju 0,9% nātrija hlorīda šķīduma ievadīšanu dzemdes dobumā) priekšrocību salīdzinājumā ar histerosalpingogrāfiju, jo tā ļauj veikt diferenciāldiagnozi starp intrauterīno starpsienu un divragaino dzemdi. Ar sonohistērogrāfijas palīdzību ir iespējams ne tikai pētīt dzemdes dobuma formu, bet arī noteikt dzemdes ķermeņa dibena konfigurāciju. Mūsu valstī šī metode nav plaši izplatīta.
- Dažos sarežģītos gadījumos diagnozes pārbaudei izmanto iegurņa orgānu MRI. Šī metode ļauj iegūt vērtīgu informāciju dzemdes attīstības anomāliju gadījumā, ko pavada netipisks orgānu izvietojums iegurnī. MRI ir svarīga rudimentāra dzemdes raga gadījumā, lai izlemtu, vai ir ieteicams to noņemt. Nepieciešamība noņemt rudimentāro dzemdes ragu rodas, ja tas ir savienots ar olvadu un olnīcu, lai novērstu apaugļotas olšūnas veidošanos un attīstību tajā. Grūtniecības pārtraukšana dzemdes anatomisko anomāliju gadījumā var būt saistīta ar neveiksmīgu apaugļotas olšūnas implantāciju (uz intrauterīnās starpsienas, submukozā miomas mezgla tuvumā), nepietiekami attīstītu endometrija vaskularizāciju un uzņemšanu, ciešām telpiskām attiecībām dzemdes dobumā (piemēram, dobuma deformācijas gadījumā ar miomas mezglu), ko bieži pavada intrakraniālā infekciozā infekcija (ICI), un hormonāliem traucējumiem.
Parastā spontānā aborta ārstēšana
Ķirurģiska ārstēšana
Intrauterīnas starpsienas, submukozu miomas limfmezglu un saaugumu gadījumā visefektīvākā ķirurģiskā ārstēšanas metode ir histerorezektoskopija. Turpmāku spontāno abortu biežums šajā sieviešu grupā pēc ārstēšanas ir 10%, salīdzinot ar 90% pirms operācijas. Salīdzinot metroplastikas rezultātus, kas veikti ar laparotomijas un transcervikālās histerorezektoskopijas palīdzību, P. Heinonens (1997) ieguva rezultātus, kas liecina par mazāku traumu un lielāku histerorezektoskopijas efektivitāti; grūtniecību īpatsvars, kuru rezultātā piedzima dzīvotspējīgi bērni, bija attiecīgi 68 un 86%.
Intrauterīnās starpsienas, saaugumu un submukozo miomas mezglu ķirurģiska noņemšana novērš spontāno abortu 70–80 % gadījumu. Tomēr tā ir neefektīva sievietēm ar dzemdes malformācijām, kurām ir bijušas normālas dzemdības ar sekojošiem atkārtotiem spontānajiem abortiem. Visticamāk, ka šādos gadījumos anatomiskais faktors nav galvenais cēlonis, un ir jāmeklē citi spontānā aborta cēloņi.
Ir pierādīts, ka vēdera metroplastika ir saistīta ar ievērojamu pēcoperācijas neauglības risku un neuzlabo turpmākās grūtniecības prognozi. Tāpēc labāk ir dot priekšroku histeroskopijai un laparoskopiskām operācijām.
Narkotiku ārstēšana
Nav pierādīta spirāles ieviešanas, lielu estrogēnu zāļu devu, Foley katetra ievadīšanas dzemdes dobumā pēc operācijām saaugumu noņemšanai, intrauterīnās starpsienas noņemšanai efektivitāte. Grūtniecību ieteicams plānot ne agrāk kā 3 mēnešus pēc operācijas. Lai uzlabotu endometrija augšanu, cikliska hormonu terapija tiek veikta 3 menstruālo ciklu garumā [14]. 3 mēnešus cikla pirmajās 14 dienās ieteicams lietot zāles, kas satur 2 mg 17-beta-estradiola, nākamo 14 dienu laikā - 2 mg 17-beta-estradiola un 20 mg didrogesterona (10 mg didrogesterona kā daļa no kombinētā medikamenta plus 10 mg didrogesterona atsevišķā tablešu veidā).
Pacienta turpmākā aprūpe
Grūtniecības gaitas iezīmes ar divkornu dzemdi vai dzemdes dubultošanos (ja ir 2 dzemdes dobumi):
- grūtniecības sākumposmā asiņošana bieži rodas no "tukšā" raga vai dzemdes dobuma izteiktas deciduālas reakcijas dēļ; taktikai šajā gadījumā jābūt konservatīvai un jāsastāv no spazmolītisku un hemostatisku līdzekļu lietošanas;
- grūtniecības pārtraukšanas draudi dažādos posmos;
- isthmic-cervikālās nepietiekamības attīstība;
- Intrauterīna augšanas aizture placentas nepietiekamības dēļ.
Grūtniecības sākumposmā asiņošanas gadījumā ieteicams ievērot gultas un daļēju gultas režīmu, kā arī lietot hemostatiskus, spazmolītiskus un sedatīvus līdzekļus, kā arī terapiju ar gestagēniem (didrogesteronu dienas devā no 20 līdz 40 mg) līdz 16–18 grūtniecības nedēļām.
Endokrīnie cēloņi parastam abortam
Pēc dažādu autoru domām, endokrīni cēloņi spontānajam abortam veido 8 līdz 20 %. Nozīmīgākie no tiem ir luteālās fāzes deficīts (LPD), LH hipersekrēcija, vairogdziedzera disfunkcija un cukura diabēts.
Smaga vairogdziedzera slimība vai cukura diabēts var izraisīt atkārtotus spontānos abortus. Tomēr kompensēta cukura diabēta gadījumā ieraduma spontāno abortu risks neatšķiras no riska vispārējā populācijā.
Vienlaikus augstais hipotireozes sastopamības biežums populācijā prasa skrīningu ar TSH līmeņa mērījumiem. Pacientēm ar ierastu spontāno abortu luteālās fāzes nepietiekamība tiek novērota 20–60% gadījumu, bet policistisko olnīcu ultraskaņas pazīmes - 44–56%. Saskaņā ar literatūru, atsevišķu hormonālo traucējumu ietekme uz ierasta spontānā aborta simptomu kompleksa veidošanos joprojām ir pretrunīga. M. Ogasawara et al. (1997) pētījumi neatklāja ticamas atšķirības grūtniecības pārtraukšanas biežumā ar un bez LPI pacientiem ar diviem vai vairākiem iepriekšējiem spontānajiem abortiem anamnēzē, izslēdzot autoimūnus, anatomiskus un infekcijas cēloņus.
Dzeltenā ķermeņa funkcijas nepietiekamība var būt vairāku nelabvēlīgu faktoru rezultāts:
- FSH un LH sekrēcijas traucējumi menstruālā cikla pirmajā fāzē;
- agra vai, gluži pretēji, pārāk vēla LH izdalīšanās virsotne;
- Hipoestrogēnisms nepietiekamas folikuloģenēzes rezultātā. Visi šie stāvokļi nav koriģējami ar aizstājterapiju ar gestagēniem pēcovulācijas periodā. L. Regana u.c. veiktie prospektīvie pētījumi uzrādīja ievērojamu spontāno abortu biežuma palielināšanos pacientiem ar LH hipersekrēciju menstruālā cikla 8. dienā, salīdzinot ar sievietēm ar normālu LH līmeni asinīs (attiecīgi 65% un 12% spontāno abortu). Nelaikā LH pieplūduma kaitīgā ietekme ir saistīta ar priekšlaicīgu otrās meiotiskās dalīšanās atsākšanos un nenobriedušas olšūnas ovulāciju, kā arī ar androgēnu ražošanas indukciju teka šūnās kopā ar endometrija uztveršanas traucējumiem gestagēna nepietiekamības ietekmē. Tomēr preovulācijas LH līmeņa provizoriska samazināšana ar gonadotropīnu atbrīvojošā hormona agonistiem bez papildu pasākumiem, kuru mērķis ir pagarināt turpmāko grūtniecību, nenodrošina paredzēto spontāno abortu biežuma samazināšanos.
NLF diagnostikas zelta standarts ir endometrija biopsijas materiāla histoloģiska izmeklēšana cikla otrajā fāzē divu menstruālo ciklu laikā.
Citu ovulācijas disfunkcijas cēloņu, piemēram, hiperprolaktinēmijas, hipotireozes, funkcionālā androgēnu (olnīcu vai virsnieru) pārpalikuma, diagnozei jāpievieno atbilstošas ārstēšanas nozīmēšana.
Diagnostika
Anamnēze un fiziskā apskate
- Anamnēze. Faktori, kas jāņem vērā: vēla menstruācija, neregulārs menstruālais cikls (oligomenoreja, amenoreja, pēkšņa svara palielināšanās, svara zudums, neauglība, regulāri agri spontānie aborti).
- Izmeklēšana: ķermeņa tips, augums, ķermeņa svars, hirsutisms, sekundāro dzimumpazīmju smaguma pakāpe, striju klātbūtne, piena dziedzeru pārbaude galaktorejas noteikšanai.
- Funkcionālās diagnostikas testi: taisnās zarnas temperatūras mērīšana 3 menstruālo ciklu laikā.
Īpašas pētījumu metodes
- Hormonālais pētījums:
- menstruālā cikla 1. fāzē (7.–8. dienā) – FSH, LH, prolaktīna, TSH, testosterona, 17-hidroksiprogesterona (17-OP), DHEAS satura noteikšana;
- menstruālā cikla 2. fāzē (21–22 dienas) – progesterona satura noteikšana (normatīvie progesterona līmeņa rādītāji ir ļoti mainīgi, metodi nevar izmantot, neņemot vērā citus faktorus).
- Ultraskaņa:
- menstruālā cikla 1. fāzē (5.–7. dienā) – endometrija patoloģijas, policistisko olnīcu diagnostika;
- Menstruālā cikla 2. fāzē (20–21 diena) – endometrija biezuma mērīšana (normāli 10–11 mm, korelē ar progesterona saturu).
- Endometrija biopsija NLF pārbaudei tiek veikta 2 dienas pirms paredzamajām menstruācijām (26. dienā ar 28 dienu ciklu). Šo metodi izmanto gadījumos, kad diagnoze nav skaidra. Lai pētītu endometrija izmaiņas tā sauktajā "implantācijas loga" periodā, biopsija tiek veikta 6. dienā pēc ovulācijas.
Ārstēšana
Diagnozējot NLF (saskaņā ar taisnās zarnas temperatūras diagrammām, 2. fāzes ilgums ir mazāks par 11 dienām, tiek novērota pakāpeniska temperatūras paaugstināšanās, nepietiekama endometrija sekrēcijas transformācija saskaņā ar endometrija biopsijas datiem, zems progesterona līmenis asins serumā), ir nepieciešams identificēt šādu traucējumu cēloni.
Ja NLF pavada hiperprolaktinēmija, tiek veikta smadzeņu MRI. Alternatīva metode ir galvaskausa (sella turcica reģions) rentgenogrāfija.
Hiperprolaktinēmijas pirmais posms ir hipofīzes adenomas izslēgšana, kam nepieciešama ķirurģiska ārstēšana. Ja nav būtisku izmaiņu, hiperprolaktinēmija tiek uzskatīta par funkcionālu, un bromokriptīna terapija tiek nozīmēta, lai normalizētu prolaktīna līmeni. Bromokriptīna sākotnējā deva ir 1,25 mg/dienā 2 nedēļas, pēc prolaktīna līmeņa kontroles, ja indikatori nenormalizējas, devu palielina līdz 2,5 mg/dienā. Ar ievērojamu prolaktīna līmeņa paaugstināšanos sākotnējā deva ir 2,5 mg/dienā. Ja iestājas grūtniecība, bromokriptīna lietošana jāpārtrauc.
Ja tiek atklāta hipotireoze, kopā ar endokrinologu tiek noteikts vairogdziedzera patoloģijas raksturs. Jebkurā gadījumā ir indicēta ikdienas nātrija levotiroksīna terapija, deva tiek izvēlēta individuāli, līdz TSH līmenis normalizējas. Ja iestājas grūtniecība, nātrija levotiroksīna terapija jāturpina. Jautājums par devas palielināšanas lietderību grūtniecības pirmajā trimestrī tiek izlemts kopā ar endokrinologu pēc hormonālās izmeklēšanas rezultātu (TSH līmenis, brīvais tiroksīns) saņemšanas.
NLF korekcija tiek veikta vienā no diviem veidiem. Pirmais veids ir ovulācijas stimulēšana, otrais veids ir aizstājterapija ar progesterona preparātiem.
Pirmā ārstēšanas iespēja ir ovulācijas stimulēšana ar klomifēna citrātu. Šī ārstēšanas metode ir balstīta uz faktu, ka lielākā daļa luteālās fāzes traucējumu rodas cikla folikulārajā fāzē. Pastāvīgi pazemināts progesterona līmenis otrajā fāzē ir folikuloģenēzes traucējumu sekas cikla pirmajā fāzē. Šo traucējumu veiksmīgāk var koriģēt ar nelielām klomifēna citrāta devām agrīnā folikulārajā fāzē, nevis nozīmējot progesteronu cikla otrajā fāzē.
1. ciklā klomifēna citrāta deva ir 50 mg/dienā no menstruālā cikla 5. līdz 9. dienai. Efektivitāti uzrauga, izmantojot rektālās temperatūras mērījumus, progesterona līmeņa mērījumus cikla 2. fāzē vai dinamisko ultraskaņu. Ja 2. ovulācijas stimulācijas ciklā nav pietiekamas iedarbības, klomifēna citrāta deva jāpalielina līdz 100 mg/dienā no 5. līdz 9. cikla dienai. Maksimālā iespējamā deva 3. ovulācijas stimulācijas ciklā ir 150 mg/dienā. Šāda devas palielināšana ir iespējama tikai tad, ja zāles ir labi panesamas (nav intensīvu sāpju vēdera lejasdaļā un muguras lejasdaļā, kā arī citu olnīcu hiperstimulācijas pazīmju).
Otra ārstēšanas iespēja: aizstājterapija ar progesterona preparātiem, kas veicina pilnīgu endometrija sekrēcijas transformāciju, kas dod nepieciešamo efektu pacientēm ar ierastu spontāno abortu ar saglabātu ovulāciju. Turklāt pēdējos gados ir konstatēts, ka progesterona preparātu ievadīšanai ir ne tikai hormonāla, bet arī imūnmodulējoša iedarbība, nomācot imūnkompetentu šūnu atgrūšanas reakcijas endometrijā. Jo īpaši līdzīga iedarbība ir aprakstīta dihidrogesteronam devā 20 mg/dienā. Aizvietošanas terapijas nolūkos didrogesteronu lieto iekšķīgi 20 mg/dienā devā vai mikronizētu progesteronu vagināli 200 mg/dienā devā. Ārstēšana tiek veikta 2. dienā pēc ovulācijas (dienā pēc rektālās temperatūras paaugstināšanās) un turpinās 10 dienas. Ja iestājas grūtniecība, ārstēšana ar progesterona preparātiem jāturpina.
Mūsdienu pētījumi nav apstiprinājuši cilvēka horiona gonadotropīna efektivitāti atkārtotu spontāno abortu ārstēšanā.
Hiperandrogenisma (olnīcu vai virsnieru ģenēzes) gadījumā pacientiem ar ierastu spontāno abortu ārstēšana ir indicēta androgēnu ietekmes uz ovulācijas pilnīgumu un endometrija stāvokli dēļ. Virsnieru androgēnu biosintēzes pārkāpuma gadījumā ir iespējama to virilizējošā iedarbība uz sieviešu dzimuma augli, tāpēc steroīdu terapija tiek veikta augļa interesēs.
Olnīcu ģenēzes hiperandrogenisms (policistisko olnīcu slimība)
Anamnēze, fiziskā apskate un speciālo pārbaužu rezultāti
- Anamnēze: vēla menstruāciju sākšanās, menstruālā cikla traucējumi, piemēram, oligomenoreja (parasti primāra, retāk sekundāra). Grūtniecība ir reta, parasti spontāni pārtraucas pirmajā trimestrī, ar ilgstošiem neauglības periodiem starp grūtniecībām.
- Izmeklēšana: hirsutisms, pinnes, strijas, augsts ķermeņa masas indekss (pēc izvēles).
- Taisnās zarnas temperatūras diagrammas: anovulācijas cikli mijas ar cikliem ar ovulāciju un NLF.
- Hormonālā izmeklēšana: augsts testosterona līmenis, FSH un LH līmenis var būt paaugstināts, LH/FSH attiecība ir lielāka par 3. Ultrasonogrāfija: policistisko olnīcu klātbūtne.
Ārstēšana
Nemedikamentoza ārstēšana
Svara zaudēšana - diētas terapija, fiziskās aktivitātes.
Narkotiku ārstēšana
- Orlistats 120 mg devā ar katru galveno ēdienreizi. Kursa ilgums tiek noteikts, ņemot vērā iedarbību un panesamību.
- Sākotnēja testosterona līmeņa samazināšana ar preparātiem, kas satur ciproterona acetātu (2 mg) un EE (35 mcg), 3 menstruālo ciklu laikā.
- Kontracepcijas pārtraukšana, cikla otrās fāzes hormonālais atbalsts (gestagēnterapija) - didrogesterons 20 mg/dienā devā no menstruālā cikla 16. līdz 25. dienai. Ja spontānas ovulācijas nav, pāriet uz nākamo posmu.
- Ovulācijas stimulēšana ar klomifēna citrātu sākotnējā devā 50 mg dienā no menstruālā cikla 5. līdz 9. dienai, vienlaikus lietojot gestagēnus (didrogesteronu 20 mg dienā no 16. līdz 25. cikla dienai) un deksametazonu (0,5 mg).
- Ja grūtniecības nav, klomifēna citrāta devu palielina līdz 100–150 mg dienā, lietojot gestagēnus cikla otrajā fāzē un deksametazonu (0,5 mg). Ir konstatēts, ka, lai gan deksametazons samazina tikai virsnieru androgēnu līmeni, ovulācija un apaugļošanās notiek ievērojami biežāk, ārstējot ar klomifēna citrātu un deksametazonu, nekā lietojot tikai klomifēna citrātu [12].
- Tiek veikti trīs ovulācijas stimulācijas cikli, pēc kuriem ieteicams pārtraukt trīs menstruālos ciklus ar gestagēnu atbalstu un pieņemt lēmumu par ķirurģisku ārstēšanu, izmantojot laparoskopisku piekļuvi (olnīcu ķīļveida rezekcija, lāzera iztvaikošana).
Pacienta turpmākā aprūpe
Grūtniecības uzraudzībai līdz 16 grūtniecības nedēļām jāpievieno gestagēna atbalsts (didrogesterons 20 mg/dienā vai mikronizēts progesterons 200 mg/dienā), deksametazons tiek nozīmēts tikai grūtniecības pirmajā trimestrī. Lai savlaicīgi diagnosticētu istmiski-dzemdes kakla nepietiekamību un, ja nepieciešams, veiktu tās ķirurģisku korekciju, ir nepieciešama uzraudzība.
Virsnieru hiperandrogenisms (pubertātes un pēcpubertātes adrenogenitālais sindroms)
Adrenogenitālais sindroms (AGS) ir iedzimta slimība, kas saistīta ar virsnieru garozas hormonu sintēzes traucējumiem gēnu bojājumu dēļ, kas atbild par vairāku enzīmu sistēmu sintēzi. Slimība tiek mantota autosomāli recesīvā veidā, mutantu gēnu pārnešanai no abiem vecākiem, kuri ir veseli nesēji.
90% gadījumu adrenogenitālo sindromu izraisa CYP21B gēna mutācijas, kas izraisa 21-hidroksilāzes sintēzes traucējumus.
Anamnēze, fiziskā apskate un speciālo pārbaužu rezultāti
- Anamnēze: vēlīnas menstruācijas, nedaudz pagarināts menstruālais cikls, iespējama oligomenoreja, spontāni aborti pirmajā trimestrī, iespējama neauglība.
- Izmeklēšana: akne, hirsutisms, androida ķermeņa tips (plati pleci, šaurs iegurnis), klitora hipertrofija.
- Taisnās zarnas temperatūras diagrammas: anovulācijas cikli mijas ar cikliem ar ovulāciju un NLF.
- Hormonālais tests: augsts 17-OP, DHEAS līmenis.
- Ultraskaņa: olnīcas nav mainījušās.
Patognomoniska pazīme ārpus grūtniecības ir 17-OP koncentrācijas palielināšanās asins plazmā.
Pašlaik virsnieru hiperandrogenisma latentās, neklasiskās formas diagnosticēšanai tiek izmantots tests ar AKTH. Šim testam tiek izmantots Synacthen - sintētisks polipeptīds, kam piemīt endogēnā AKTH īpašības, t.i., tas stimulē steroīdo hormonu sintēzes sākotnējās fāzes no holesterīna virsnieru dziedzeros.
Synacthen tests (AKTH analogs): 1 ml (0,5 mg) synacthen tiek injicēts subkutāni plecā, sākotnējais 17-OP un kortizola saturs vispirms tiek noteikts rīta 9 stundu asins plazmas paraugā. 9 stundas pēc injekcijas tiek ņemts kontroles asins paraugs, lai noteiktu 17-OP un kortizola līmeni. Pēc tam noteikšanas indeksu (D) aprēķina, izmantojot formulu:
D = 0,052 × 17-OP + 0,005 × kortizols/17-OP - 0,018 × kortizols/17-OP
Ja D koeficients ir mazāks vai vienāds ar 0,069, tas norāda uz virsnieru hiperandrogenisma neesamību. Ja D koeficients ir lielāks par 0,069, jāuzskata, ka hiperandrogenismu izraisa virsnieru dziedzeru disfunkcija.
Narkotiku ārstēšana
Galvenā ārstēšanas metode hiperandrogenisma gadījumā, ko izraisa 21-hidroksilāzes deficīts, ir glikokortikoīdi, kurus lieto, lai nomāktu pārmērīgu androgēnu sekrēciju.
Pacienta turpmākā aprūpe
Sakarā ar mātes androgēnu virilizējošo iedarbību uz augli, ja ir diagnosticēta virsnieru hiperandrogenisms, ārstēšana ar deksametazonu sākotnējā devā 0,25 mg tiek nozīmēta pirms grūtniecības un turpināta individuāli izvēlētā devā (no 0,5 līdz 1 mg) visā grūtniecības laikā. Sievietei ar pastāvīgu spontāno abortu, kas cieš no virsnieru hiperandrogenisma, nav ieteicams atcelt ārstēšanu, jo spontāno abortu biežums bez ārstēšanas sasniedz 14%, bet turpinot ārstēšanu - 9%.
Ņemot vērā to, ka pacienti ar adrenoģenitālo sindromu var nodot šo gēnu auglim, nepieciešams veikt pirmsdzemdību diagnostiku: 17.–18. grūtniecības nedēļā tiek nozīmēta asins analīze, lai noteiktu 17-OP saturu mātei. Ja hormona līmenis asinīs ir paaugstināts, tiek noteikta tā koncentrācija augļūdeņos. Ja 17-OP saturs augļūdeņos ir paaugstināts, tiek diagnosticēts augļa adrenoģenitālais sindroms. Diemžēl adrenoģenitālā sindroma smagumu (viegla vai smaga forma ar sāļu zudumu) nav iespējams noteikt pēc 17-OP līmeņa augļūdeņos. Jautājumu par grūtniecības saglabāšanu šādā situācijā izlemj vecāki.
Ja bērna tēvs ir adrenoģenitālā sindroma gēna nesējs un ģimenē ir bijuši gadījumi, kad bērni piedzimst ar šo sindromu, tad pacients, pat bez virsnieru hiperandrogenisma, augļa interesēs (lai novērstu sieviešu dzimuma augļa virilizāciju) saņem deksametazonu 20 mcg/kg ķermeņa masas devā, maksimāli 1,5 mg/dienā 2-3 devās pēc ēdienreizēm. 17-18 nedēļās, pēc augļa dzimuma un adrenoģenitālā sindroma gēna ekspresijas noteikšanas (pamatojoties uz amniocentēzes rezultātiem), ārstēšanu turpina līdz grūtniecības beigām, ja auglis ir meitene ar adrenoģenitālo sindromu. Ja auglis ir zēns vai meitene, kas nav adrenoģenitālā sindroma gēna nesēja, deksametazona lietošanu var pārtraukt.
Ja sievietei ar ierastu spontāno abortu ir virsnieru hiperandrogenisms, tad deksametazona terapija tiek veikta visas grūtniecības laikā un tiek pārtraukta tikai pēc dzemdībām. 3. dienā pēc dzemdībām deksametazona deva tiek pakāpeniski samazināta (par 0,125 mg ik pēc 3 dienām) līdz pilnīgai pārtraukšanai pēcdzemdību periodā.
Jauktas ģenēzes hiperandrogenisms (olnīcu un virsnieru)
Anamnēze, fiziskā apskate un speciālo pārbaužu rezultāti
- Anamnēze: vēla menstruāciju sākšanās, menstruālā cikla traucējumi, piemēram, oligomenoreja (parasti primāra, retāk sekundāra), amenoreja, iespējamas traumas, smadzeņu satricinājumi. Grūtniecība ir reta, parasti spontāni pārtraucas pirmajā trimestrī, ilgi neauglības periodi starp grūtniecībām.
- Fiziskā apskate: hirsutisms, akne, strijas, melnā akantoze, augsts ķermeņa masas indekss, hipertensija.
- Taisnās zarnas temperatūras diagrammas: anovulācijas cikli mijas ar cikliem ar ovulāciju un NLF.
- Hormonālā izmeklēšana: augsts testosterona līmenis, FSH un LH līmenis var būt paaugstināts, LH/FSH attiecība lielāka par 3, augsts DHEAS, 17-OP līmenis, var būt hiperprolaktinēmija.
- Ultraskaņa: policistisko olnīcu izmeklēšana.
- Elektroencefalogrāfija: smadzeņu bioelektriskās aktivitātes izmaiņas.
- Hiperinsulinēmija, lipīdu metabolisma traucējumi (augsts holesterīna līmenis, zema blīvuma lipoproteīni un ļoti zema blīvuma lipoproteīni), samazināta glikozes tolerance vai paaugstināts glikozes līmenis asinīs.
Ārstēšana
Nemedikamentoza ārstēšana
Svara zudums (zemas kaloritātes diēta, fiziskās aktivitātes).
Narkotiku ārstēšana
Pirmais posms - insulīna rezistences klātbūtnē ieteicams izrakstīt metformīnu dienas devā 1000-1500 mg, lai palielinātu jutību pret insulīnu.
Otrais posms - smagu menstruālā cikla traucējumu un augsta testosterona līmeņa gadījumā ieteicams 3 mēnešus izrakstīt zāles ar antiandrogēnu iedarbību, kas satur ciproterona acetātu (2 mg) un etinilestradiolu (35 mcg).
Trešais posms ir ovulācijas stimulēšana, kam seko gestagēna atbalsts (shēma ir aprakstīta iepriekš) un deksametazona lietošana dienas devā 0,25–0,5 mg.
Hiperprolaktinēmijas un hipotireozes gadījumā ovulācijas stimulācijas ciklos jāveic atbilstoša zāļu korekcija. Ja iestājas grūtniecība, bromokriptīna lietošana jāpārtrauc un levotiroksīna lietošana jāturpina.
Ja ovulācijas stimulācija ir neefektīva, jāizlemj jautājums par tiešu ovulācijas induktoru izrakstīšanu, policistisko olnīcu ķirurģiskas ārstēšanas vai in vitro apaugļošanas lietderību.
Pacienta turpmākā aprūpe
Pacientiem ar vielmaiņas sindromu grūtniecību bieži sarežģī arteriāla hipertensija, nefropātija, hiperkoagulācija, saistībā ar kuru nepieciešams kontrolēt asinsspiedienu, hemostaziogrammas jau no grūtniecības sākuma un koriģēt radušos traucējumus (ja nepieciešams) ar antihipertenzīviem līdzekļiem, antiagregantiem un antikoagulantiem. Progestogeniskie līdzekļi tiek izrakstīti līdz 16 grūtniecības nedēļām - didrogesterons devā 20 mg dienā vai mikronizēts progesterons devā 200 mg dienā 2 devās.
Visas sievietes ar hiperandrogenismu ir riska grupa istmiskās-dzemdes kakla nepietiekamības attīstībai. Dzemdes kakla stāvokļa kontrole jāveic no 16. grūtniecības nedēļas, ja nepieciešams - istmiskās-dzemdes kakla nepietiekamības ķirurģiska korekcija.
Imunoloģiskie ierastā spontānā aborta cēloņi
Pašlaik ir zināms, ka aptuveni 80% no visiem iepriekš neizskaidrotajiem atkārtota spontāna aborta gadījumiem (izslēdzot ģenētiskos, anatomiskos, hormonālos cēloņus) ir saistīti ar imūnsistēmas traucējumiem. Izšķir autoimūnas un alloimūnas slimības, kas izraisa ieraduma izraisītu spontāno abortu.
Autoimūnos procesos imūnsistēmas pašas audi kļūst par agresijas objektu, proti, imūnreakcija ir vērsta pret saviem antigēniem. Šādā situācijā auglis cieš sekundāri mātes audu bojājumu rezultātā.
Aloimūnu traucējumu gadījumā sievietes imūnreakcija ir vērsta pret embrionālajiem/augļa antigēniem, kas saņemti no tēva un kas potenciāli ir sveši mātes organismam.
Autoimūnas slimības, kas visbiežāk rodas pacientiem ar ieradumu spontāno abortu, ir antifosfolipīdu, antitireoīdo un antinukleāro autoantivielu klātbūtne serumā. Tādējādi ir noskaidrots, ka 31% sieviešu ar ieradumu spontāno abortu ārpus grūtniecības ir autoantivielas pret tireoglobulīnu un vairogdziedzera peroksidāzi (vairogdziedzera mikrosomu [vairogdziedzera peroksidāzes] autoantivielas); šajos gadījumos spontānā spontānā aborta risks grūtniecības pirmajā trimestrī palielinās līdz 20%. Ieraduma spontānā aborta gadījumā antinukleāro un antitireoīdo antivielu klātbūtne norāda uz nepieciešamību veikt papildu izmeklējumus, lai identificētu autoimūno procesu un pārbaudītu diagnozi.
Antifosfolipīdu sindroms (APS) joprojām ir vispārpieņemta autoimūna slimība, kas izraisa embrija/augļa nāvi.
Aloimūnas slimības
Pašlaik alloimūnie procesi, kas izraisa augļa atgrūšanu, ietver palielinātu (vairāk nekā 3) galveno histokompatibilitātes kompleksa sistēmas kopīgo antigēnu skaitu laulātajiem (bieži novērojams konsangviniskās laulībās); zemu bloķējošo faktoru līmeni mātes serumā; paaugstinātu dabisko killeršūnu (NK šūnu CD56, CD16) līmeni mātes endometrijā un perifērajās asinīs gan ārpus grūtniecības, gan tās laikā; augstu vairāku citokīnu koncentrācijas līmeni endometrijā un asins serumā, jo īpaši γ-interferonu, audzēja nekrozes faktoru a, interleikīnus-1 un 2.
Pašlaik tiek pētīti alloimūnie faktori, kas izraisa agrīnus grūtniecības spontānus abortus, un veidi, kā labot iepriekš minētos stāvokļus. Nav vienprātības par terapijas metodēm. Pēc dažu pētnieku domām, aktīva imunizācija ar donoru limfocītiem nerada būtisku efektu, savukārt citi autori apraksta būtisku pozitīvu efektu, veicot šādu imunizāciju un ārstēšanu ar imūnglobulīniem.
Pašlaik viens no imūnmodulatoriem grūtniecības sākumā ir progesterons. Jo īpaši pētījumi ir pierādījuši didrogesterona lomu 20 mg dienas devā sievietēm ar ierastu spontāno abortu grūtniecības pirmajā trimestrī ar paaugstinātu CD56 šūnu līmeni endometrijā.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Ģenētiski noteiktas trombofīlijas
Šādas ģenētiski noteiktas trombofīlijas formas tiek uzskatītas par trombofīliskiem stāvokļiem grūtniecības laikā, kas izraisa ieraduma izraisītu spontāno abortu.
- Antitrombīna III deficīts.
- V faktora mutācija (Leidena mutācija).
- C proteīna deficīts.
- S proteīna deficīts.
- Protrombīna gēna mutācija G20210A.
- Hiperhomocisteinēmija.
Lai identificētu retus trombofīlijas cēloņus, nepieciešama pārbaude gadījumos, kad ir:
- ģimenes anamnēze - trombembolija pirms 40 gadu vecuma radiniekiem;
- ticamas venozās un/vai arteriālās trombozes epizodes pirms 40 gadu vecuma;
- atkārtota tromboze pacientam un viņa tuvākajiem radiniekiem;
- trombemboliskas komplikācijas grūtniecības laikā un pēc dzemdībām, lietojot hormonālo kontracepciju;
- atkārtoti grūtniecības zaudējumi, nedzīvi dzimuši bērni, intrauterīna augšanas aizturi, placentas atdalīšanās;
- agrīna preeklampsija, HELLP sindroms.
Infekciozi cēloņi parastam abortam
Infekcijas faktora loma kā ieraduma spontānā aborta cēlonis pašlaik ir plaši apspriesta. Ir zināms, ka primārā infekcija grūtniecības sākumposmā var izraisīt embrijam ar dzīvību nesavienojamus bojājumus, kas noved pie sporādiska spontāna aborta. Tomēr infekcijas reaktivācijas varbūtība vienlaikus ar atkārtotu grūtniecības zaudējumu iznākumu ir niecīga. Turklāt pašlaik nav atrasti mikroorganismi, kas izraisa ieraduma spontānu abortu. Pēdējo gadu pētījumi liecina, ka lielākajai daļai sieviešu ar ieraduma spontānu abortu un hronisku endometrītu endometrijā ir 2-3 vai vairāk obligāto anaerobo mikroorganismu un vīrusu veidu izplatība.
Saskaņā ar V. M. Sidelņikovas u.c. datiem, sievietēm, kuras cieš no ieraduma izraisīta spontāna aborta, hroniska endometrīta diagnoze ārpus grūtniecības tika histoloģiski apstiprināta 73,1% gadījumu, un 86,7% gadījumu tika novērota oportūnistisku mikroorganismu noturība endometrijā, kas noteikti var būt imunopatoloģisko procesu aktivācijas cēlonis. Jaukta persistējoša vīrusu infekcija (herpes simplex vīruss, Coxsackie A, Coxsackie B, enterovīrusi 68–71, citomegalovīruss) pacientiem ar ieradumu izraisītu spontānu abortu tiek konstatēta ievērojami biežāk nekā sievietēm ar normālu dzemdību anamnēzi. K. Kohuts u.c. (1997) parādīja, ka iekaisuma izmaiņu procentuālais daudzums endometrijā un deciduālajos audos pacientiem ar primāru atkārtotu spontānu abortu ir ievērojami lielāks nekā sievietēm pēc spontāna aborta, kurām anamnēzē ir vismaz vienas pilna laika dzemdības.
Endometrija bakteriālā un vīrusu kolonizācija parasti rodas imūnsistēmas un organisma nespecifisko aizsargspēku (komplementa sistēmas, fagocitozes) nespējas dēļ pilnībā likvidēt infekcijas izraisītāju, un vienlaikus tā izplatību ierobežo T-limfocītu (T-palīgu, dabisko killeru) un makrofāgu aktivācija. Visos iepriekš minētajos gadījumos notiek mikroorganismu noturība, ko raksturo mononukleāro fagocītu, dabisko killeru, T-palīgu, kas sintezē dažādus citokīnus, pievilcība hroniska iekaisuma vietai. Acīmredzot šāds endometrija stāvoklis novērš lokālas imūnsupresijas veidošanos preimplantācijas periodā, kas ir nepieciešama, lai izveidotu aizsargbarjeru un novērstu pussveša augļa atgrūšanu.
Šajā sakarā pirms grūtniecības sievietēm ar ieradumu spontāno abortu jādiagnosticē hronisks endometrīts. Lai noteiktu vai izslēgtu šo diagnozi, menstruālā cikla 7.-8. dienā tiek veikta endometrija biopsija ar histoloģisku izmeklēšanu, PĶR un bakterioloģisku dzemdes dobuma materiāla izmeklēšanu. Pārbaudot diagnozi, hronisks endometrīts tiek ārstēts saskaņā ar iegurņa orgānu iekaisuma slimību ārstēšanas standartiem.

