
Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Kateholamīnu sintēze, sekrēcija un metabolisms
Raksta medicīnas eksperts
Pēdējā pārskatīšana: 06.07.2025
Virsnieru serde ražo savienojumus, kuru struktūra ir tālu no steroīdiem. Tie satur 3,4-dihidroksifenila (katehola) kodolu un tiek saukti par kateholamīniem. Tie ietver adrenalīnu, noradrenalīnu un dopamīna beta-hidroksitiramīnu.
Kateholamīnu sintēzes secība ir pavisam vienkārša: tirozīns → dihidroksifenilalanīns (DOPA) → dopamīns → norepinefrīns → adrenalīns. Tirozīns nonāk organismā ar pārtiku, bet var veidoties arī no fenilalanīna aknās fenilalanīna hidroksilāzes iedarbībā. Tirozīna konversijas galaprodukti audos ir atšķirīgi. Virsnieru serdē process turpinās līdz adrenalīna veidošanās stadijai, simpātisko nervu galos - norepinefrīns, dažos centrālās nervu sistēmas neironos kateholamīnu sintēze beidzas ar dopamīna veidošanos.
Tirozīna pārvēršanu par DOPA katalizē tirozīna hidroksilāze, kuras kofaktori ir tetrahidrobiopterīns un skābeklis. Tiek uzskatīts, ka šis enzīms ierobežo visa kateholamīnu biosintēzes procesa ātrumu un to kavē procesa galaprodukti. Tirozīna hidroksilāze ir galvenais regulējošās ietekmes mērķis uz kateholamīnu biosintēzi.
DOPA pārvēršanu par dopamīnu katalizē enzīms DOPA dekarboksilāze (kofaktors - piridoksāla fosfāts), kas ir relatīvi nespecifisks un dekarboksilē citas aromātiskās L-aminoskābes. Tomēr pastāv norādes uz iespēju modificēt kateholamīnu sintēzi, mainot šī enzīma aktivitāti. Dažiem neironiem trūkst enzīmu dopamīna tālākai pārveidošanai, un tas ir gala produkts. Citos audos ir dopamīna beta-hidroksilāze (kofaktori - varš, askorbīnskābe un skābeklis), kas pārvērš dopamīnu par norepinefrīnu. Virsnieru serdē (bet ne simpātisko nervu galos) atrodas feniletanolamīns - metiltransferāze, kas no norepinefrīna veido adrenalīnu. Šajā gadījumā S-adenozilmetionīns kalpo kā metilgrupu donors.
Ir svarīgi atcerēties, ka feniletanolamīna-N-metiltransferāzes sintēzi inducē glikokortikoīdi, kas no garozas caur portālo vēnu sistēmu nonāk serdē. Tas varētu izskaidrot faktu, ka vienā orgānā ir apvienoti divi dažādi endokrīnie dziedzeri. Glikokortikoīdu nozīmi adrenalīna sintēzē uzsver fakts, ka virsnieru serdes šūnas, kas ražo noradrenalīnu, atrodas ap arteriālajiem asinsvadiem, savukārt adrenalīnu ražojošās šūnas asinis galvenokārt saņem no venozajiem sinusiem, kas atrodas virsnieru garozā.
Kateholamīnu sadalīšanās notiek galvenokārt divu enzīmu sistēmu ietekmē: katehola-O-metiltransferāzes (COMT) un monoamīnoksidāzes (MAO). Galvenie adrenalīna un noradrenalīna sadalīšanās ceļi shematiski parādīti 54. attēlā. KOMT ietekmē metilgrupas donora S-adrenozilmetionīna klātbūtnē kateholamīni tiek pārvērsti par normetanefrīnu un metanefrīnu (noradrenalīna un adrenalīna 3-O-metilatvasinājumi), kas MAO ietekmē tiek pārvērsti par aldehīdiem un pēc tam (aldehīdoksidāzes klātbūtnē) par vanililmandelīnskābi (VMA), kas ir galvenais noradrenalīna un adrenalīna sadalīšanās produkts. Tajā pašā gadījumā, kad kateholamīni sākotnēji tiek pakļauti MAO, nevis KOMT iedarbībai, tie tiek pārvērsti par 3,4-dioksomandēlaldehīdu un pēc tam aldehīdoksidāzes un KOMT ietekmē par 3,4-dioksomandēlskābi un VMC. Alkohola dehidrogenāzes klātbūtnē no kateholamīniem var veidoties 3-metoksi-4-oksifenilglikols, kas ir galvenais adrenalīna un noradrenalīna noārdīšanās gala produkts CNS.
Dopamīna sadalīšanās notiek līdzīgi, izņemot to, ka tā metabolītiem trūkst hidroksilgrupas pie beta-oglekļa atoma, un tāpēc vanililmandelskābes vietā veidojas homovanilskābe (HVA) jeb 3-metoksi-4-hidroksifeniletiķskābe.
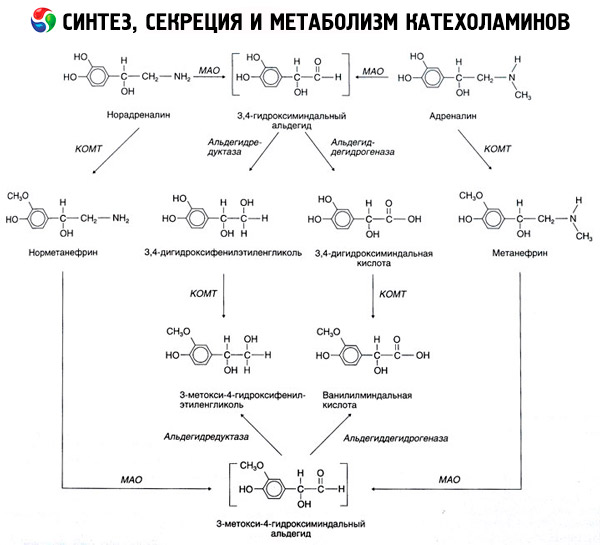
Tiek postulēta arī kateholamīna molekulas oksidācijas kvinoīda ceļa esamība, kas var radīt starpproduktus ar izteiktu bioloģisko aktivitāti.
Norepinefrīns un adrenalīns, kas veidojas citozola enzīmu iedarbībā simpātiskajos nervu galos un virsnieru serdē, nonāk sekrēcijas granulās, kas pasargā tās no degradācijas enzīmu iedarbības. Kateholamīnu uztveršana ar granulām prasa enerģijas patēriņu. Virsnieru serdes hromafīna granulās kateholamīni ir cieši saistīti ar ATP (attiecībā 4:1) un specifiskiem proteīniem - hromogranīniem, kas novērš hormonu difūziju no granulām citoplazmā.
Tiešais kateholamīnu sekrēcijas stimuls acīmredzot ir kalcija iekļūšana šūnā, stimulējot eksocitozi (granulu membrānas saplūšana ar šūnas virsmu un to plīsums ar pilnīgu šķīstošā satura - kateholamīnu, dopamīna beta-hidroksilāzes, ATP un hromogranīnu - izdalīšanos ārpusšūnu šķidrumā).
Kateholamīnu fizioloģiskā iedarbība un to darbības mehānisms
Kateholamīnu iedarbība sākas, mijiedarbojoties ar specifiskiem mērķa šūnu receptoriem. Kamēr vairogdziedzera un steroīdo hormonu receptori ir lokalizēti šūnu iekšienē, kateholamīnu (kā arī acetilholīna un peptīdu hormonu) receptori atrodas uz šūnas ārējās virsmas.
Jau sen ir pierādīts, ka attiecībā uz dažām reakcijām adrenalīns vai noradrenalīns ir efektīvāki par sintētisko kateholamīnu izoproterenolu, savukārt attiecībā uz citām izoproterenola iedarbība ir pārāka par adrenalīna vai noradrenalīna iedarbību. Pamatojoties uz to, tika izstrādāta koncepcija par divu veidu adrenoreceptoru klātbūtni audos: alfa un beta, un dažos no tiem var būt tikai viens no šiem diviem veidiem. Izoproterenols ir visspēcīgākais beta adrenoreceptoru agonists, savukārt sintētiskais savienojums fenilefrīns ir visspēcīgākais alfa adrenoreceptoru agonists. Dabiskie kateholamīni - adrenalīns un noradrenalīns - spēj mijiedarboties ar abu veidu receptoriem, bet adrenalīnam ir lielāka afinitāte pret beta, bet noradrenalīnam - pret alfa receptoriem.
Kateholamīni aktivizē sirds beta adrenerģiskos receptorus spēcīgāk nekā gludo muskuļu beta receptorus, kas ļāva beta tipu iedalīt apakštipos: beta1 receptori (sirds, tauku šūnas) un beta2 receptori (bronhi, asinsvadi utt.). Izoproterenola ietekme uz beta1 receptoriem tikai 10 reizes pārsniedz adrenalīna un noradrenalīna ietekmi, savukārt uz beta2 receptoriem tas iedarbojas 100–1000 reizes spēcīgāk nekā dabiskie kateholamīni.
Specifisku antagonistu (fentolamīna un fenoksibenzamīna alfa un propranolola beta receptoriem) lietošana apstiprināja adrenoreceptoru klasifikācijas atbilstību. Dopamīns spēj mijiedarboties gan ar alfa, gan beta receptoriem, taču arī dažādiem audiem (smadzenēm, hipofīzei, asinsvadiem) ir savi dopamīnerģiskie receptori, kuru specifiskais blokators ir haloperidols. Beta receptoru skaits svārstās no 1000 līdz 2000 uz vienu šūnu. Kateholamīnu bioloģiskā iedarbība, ko mediē beta receptori, parasti ir saistīta ar adenilātciklāzes aktivāciju un cAMP intracelulārā satura palielināšanos. Lai gan receptors un enzīms ir funkcionāli saistīti, tie ir dažādas makromolekulas. Guanozīna trifosfāts (GTP) un citi purīna nukleotīdi piedalās adenilātciklāzes aktivitātes modulācijā hormonu-receptoru kompleksa ietekmē. Palielinot enzīmu aktivitāti, šķiet, ka tie samazina beta receptoru afinitāti pret agonistiem.
Denervētu struktūru paaugstinātas jutības fenomens ir zināms jau sen. Gluži pretēji, ilgstoša agonistu iedarbība samazina mērķa audu jutību. Beta receptoru izpēte ir ļāvusi izskaidrot šīs parādības. Ir pierādīts, ka ilgstoša izoproterenola iedarbība noved pie adenilātciklāzes jutības zuduma beta receptoru skaita samazināšanās dēļ.
Desensibilizācijas process neprasa olbaltumvielu sintēzes aktivāciju un, iespējams, ir saistīts ar pakāpenisku neatgriezenisku hormonu-receptoru kompleksu veidošanos. Gluži pretēji, 6-oksidopamīna ievadīšana, kas iznīcina simpātiskos galus, ir saistīta ar reaģējošo beta receptoru skaita palielināšanos audos. Iespējams, ka simpātiskās nervu aktivitātes palielināšanās izraisa arī ar vecumu saistītu asinsvadu un taukaudu desensibilizāciju attiecībā pret kateholamīniem.
Adrenoreceptoru skaitu dažādos orgānos var kontrolēt ar citiem hormoniem. Tādējādi estradiols palielina, bet progesterons samazina alfa adrenoreceptoru skaitu dzemdē, ko pavada atbilstošs tā kontrakcijas reakcijas uz kateholamīniem pieaugums un samazinājums. Ja intracelulārais "otrais kurjers", ko veido beta receptoru agonistu darbība, noteikti ir cAMP, tad situācija attiecībā uz alfa adrenerģiskās iedarbības raidītāju ir sarežģītāka. Tiek pieņemta dažādu mehānismu esamība: cAMP līmeņa samazināšanās, cAMP satura palielināšanās, šūnu kalcija dinamikas modulācija utt.
Lai reproducētu dažādas iedarbības organismā, parasti nepieciešamas adrenalīna devas, kas ir 5–10 reizes mazākas nekā noradrenalīna devas. Lai gan pēdējais ir efektīvāks attiecībā uz α- un β1-adrenoreceptoriem, ir svarīgi atcerēties, ka abi endogēnie kateholamīni spēj mijiedarboties gan ar alfa-, gan beta1-adrenoreceptoriem. Tāpēc konkrētā orgāna bioloģiskā reakcija uz adrenerģisko aktivāciju lielā mērā ir atkarīga no tajā esošo receptoru veida. Tomēr tas nenozīmē, ka simpātiskās-virsnieru sistēmas nervu vai humorālās saites selektīva aktivācija nav iespējama. Vairumā gadījumu tiek novērota tās dažādo saišu aktivitātes palielināšanās. Tādējādi ir vispārpieņemts, ka hipoglikēmija refleksīvi aktivizē virsnieru serdi, savukārt asinsspiediena pazemināšanos (posturālu hipotensiju) galvenokārt pavada noradrenalīna izdalīšanās no simpātisko nervu galiem.
Adrenoreceptori un to aktivācijas ietekme dažādos audos
Sistēma, orgāns |
Adrenerģisko receptoru tips |
Reakcija |
Sirds un asinsvadu sistēma: |
||
Sirds |
Beta versija |
Paātrināta sirdsdarbība, vadītspēja un kontraktilitāte |
Arteriolas: |
||
Āda un gļotādas |
Alfa |
Samazināšana |
Skeleta muskuļi |
Beta versija |
Izplešanās Kontrakcija |
Vēdera dobuma orgāni |
Alfa (vairāk) |
Samazināšana |
Beta versija |
Paplašinājums |
|
Vēnas |
Alfa |
Samazināšana |
Elpošanas sistēma: |
||
Bronhu muskuļi |
Beta versija |
Paplašinājums |
Gremošanas sistēma: |
||
Kuņģis |
Beta versija |
Samazinātas motoriskās prasmes |
Zarnas |
Alfa |
Sfinkteru kontrakcija |
Liesa |
Alfa |
Samazināšana |
Beta versija |
Relaksācija |
|
Eksokrīna aizkuņģa dziedzera |
Alfa |
Samazināta sekrēcija |
Uroģenitālā sistēma: |
Alfa |
Sfinktera kontrakcija |
Urīnpūslis |
Beta versija |
Izvadītāja muskuļa relaksācija |
Vīriešu dzimumorgāni |
Alfa |
Ejakulācija |
Acis |
Alfa |
Zīlīšu paplašināšanās |
Āda |
Alfa |
Pastiprināta svīšana |
Siekalu dziedzeri |
Alfa |
Kālija un ūdens izdalīšanās |
Beta versija |
Amilāzes sekrēcija |
|
Endokrīnie dziedzeri: |
||
Aizkuņģa dziedzera saliņas |
||
Beta šūnas |
Alfa (vairāk) |
Samazināta insulīna sekrēcija |
Beta versija |
Paaugstināta insulīna sekrēcija |
|
Alfa šūnas |
Beta versija |
Paaugstināta glikagona sekrēcija |
8 šūnu |
Beta versija |
Paaugstināta somatostatīna sekrēcija |
Hipotalāms un hipofīze: |
||
Somatotrofi |
Alfa |
Paaugstināta STH sekrēcija |
Beta versija |
Samazināta STH sekrēcija |
|
Laktotrofi |
Alfa |
Samazināta prolaktīna sekrēcija |
Tireotrofi |
Alfa |
Samazināta TSH sekrēcija |
Kortikotrofi |
Alfa |
Paaugstināta AKTH sekrēcija |
| beta | Samazināta AKTH sekrēcija | |
Vairogdziedzeris: |
||
Folikulārās šūnas |
Alfa |
Samazināta tiroksīna sekrēcija |
Beta versija |
Paaugstināta tiroksīna sekrēcija |
|
Parafolikulārās (K) šūnas |
Beta versija |
Paaugstināta kalcitonīna sekrēcija |
Parathormona dziedzeri |
Beta versija |
Paaugstināta PTH sekrēcija |
Nieres |
Beta versija |
Paaugstināta renīna sekrēcija |
Kuņģis |
Beta versija |
Paaugstināta gastrīna sekrēcija |
BX |
Beta versija |
Palielināts skābekļa patēriņš |
Aknas |
? |
Paaugstināta glikogenolīze un glikoneoģenēze, atbrīvojot glikozi; pastiprināta ketoģenēze, atbrīvojot ketonvielas. |
Taukaudi |
Beta versija |
Paaugstināta lipolīze, atbrīvojot brīvās taukskābes un glicerīnu |
Skeleta muskuļi |
Beta versija |
Paaugstināta glikolīze, atbrīvojoties piruvātam un laktātam; samazināta proteolīze, samazinoties alanīna un glutamīna izdalīšanās apjomam. |
Ir svarīgi ņemt vērā, ka kateholamīnu intravenozas ievadīšanas rezultāti ne vienmēr adekvāti atspoguļo endogēno savienojumu iedarbību. Tas galvenokārt attiecas uz norepinefrīnu, jo organismā tas galvenokārt netiek izvadīts asinīs, bet tieši sinaptiskajās spraugās. Tādēļ endogēnais norepinefrīns aktivizē, piemēram, ne tikai asinsvadu alfa receptorus (paaugstināts asinsspiediens), bet arī sirds beta receptorus (paātrināta sirdsdarbība), savukārt norepinefrīna ievadīšana no ārpuses galvenokārt noved pie asinsvadu alfa receptoru aktivācijas un refleksīvas (caur vagusu) sirdsdarbības palēnināšanās.
Zemas adrenalīna devas galvenokārt aktivizē muskuļu asinsvadu un sirds beta receptorus, kā rezultātā samazinās perifēro asinsvadu pretestība un palielinās sirds izsviede. Dažos gadījumos var dominēt pirmais efekts, un pēc adrenalīna ievadīšanas attīstās hipotensija. Lielākās devās adrenalīns aktivizē arī alfa receptorus, kam pievienojas perifēro asinsvadu pretestības palielināšanās un, ņemot vērā sirds izsviedes palielināšanos, paaugstina arteriālo spiedienu. Tomēr tā ietekme uz asinsvadu beta receptoriem saglabājas arī. Rezultātā sistoliskā spiediena pieaugums pārsniedz līdzīgu diastoliskā spiediena rādītāju (pulsa spiediena pieaugums). Ieviešot vēl lielākas devas, sāk dominēt adrenalīna alfa mimētiskā iedarbība: sistoliskais un diastoliskais spiediens palielinās paralēli, tāpat kā norepinefrīna ietekmē.
Kateholamīnu ietekme uz metabolismu sastāv no to tiešās un netiešās iedarbības. Pirmās galvenokārt tiek realizētas caur beta receptoriem. Sarežģītāki procesi ir saistīti ar aknām. Lai gan palielināta aknu glikogenolīze tradicionāli tiek uzskatīta par beta receptoru aktivācijas rezultātu, ir arī pierādījumi par alfa receptoru iesaistīšanos. Kateholamīnu netiešā ietekme ir saistīta ar daudzu citu hormonu, piemēram, insulīna, sekrēcijas modulāciju. Adrenalīna iedarbībā uz tā sekrēciju nepārprotami dominē alfa adrenerģiskais komponents, jo ir pierādīts, ka jebkuru stresu pavada insulīna sekrēcijas inhibīcija.
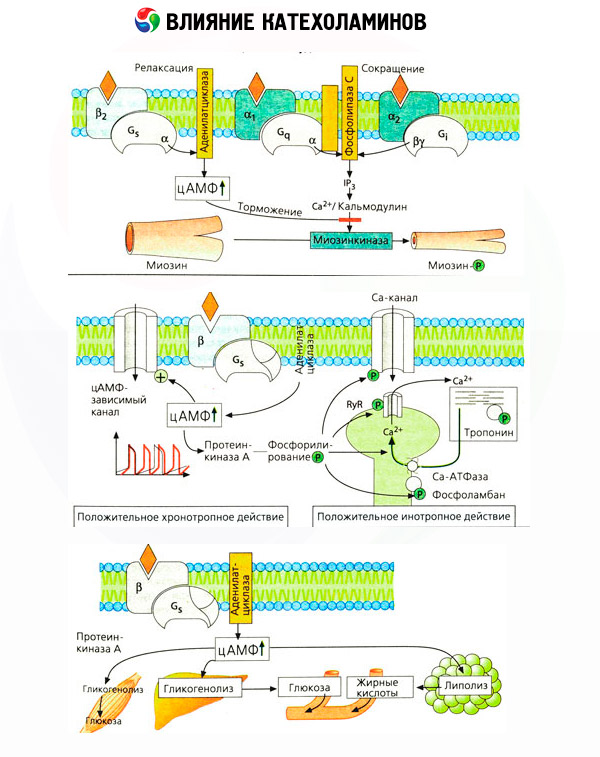
Kateholamīnu tiešās un netiešās iedarbības kombinācija izraisa hiperglikēmiju, kas saistīta ne tikai ar palielinātu aknu glikozes veidošanos, bet arī ar tās izmantošanas kavēšanu perifērajos audos. Lipolīzes paātrināšanās izraisa hiperlipacidēmiju, palielinoties taukskābju piegādei aknām un pastiprinoties ketonvielu ražošanai. Pastiprināta glikolīze muskuļos izraisa laktāta un piruvāta izdalīšanās palielināšanos asinīs, kas kopā ar no taukaudiem izdalīto glicerīnu kalpo kā aknu glikoneoģenēzes prekursori.
Kateholamīnu sekrēcijas regulēšana. Simpātiskās nervu sistēmas un virsnieru serdes produktu un reakcijas metožu līdzība bija pamats šo struktūru apvienošanai vienotā ķermeņa simpātiski-virsnieru sistēmā ar tās nervu un hormonālo saišu sadalījumu. Hipotalāmā un muguras smadzeņu un iegarenās serdes centros koncentrējas dažādi aferenti signāli, no kurienes rodas eferenti ziņojumi, pārejot uz preganglionālo neironu šūnu ķermeņiem, kas atrodas muguras smadzeņu sānu ragos VIII kakla - II-III jostas segmentu līmenī.
Šo šūnu preganglionālie aksoni atstāj muguras smadzenes un veido sinaptiskus savienojumus ar neironiem, kas atrodas simpātiskās ķēdes ganglijos, vai ar virsnieru serdes šūnām. Šīs preganglionālās šķiedras ir holīnerģiskas. Pirmā fundamentālā atšķirība starp simpātiskajiem postganglionālajiem neironiem un virsnieru serdes hromafīna šūnām ir tā, ka pēdējie pārraida saņemto holīnerģisko signālu nevis ar nervu vadīšanas palīdzību (postganglionālie adrenerģiskie nervi), bet gan pa humorālo ceļu, atbrīvojot adrenerģiskos savienojumus asinīs. Otrā atšķirība ir tā, ka postganglionālie nervi ražo norepinefrīnu, bet virsnieru serdes šūnas galvenokārt ražo adrenalīnu. Šīm divām vielām ir atšķirīga ietekme uz audiem.

