
Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Asins-smadzeņu barjera
Raksta medicīnas eksperts
Pēdējā pārskatīšana: 07.07.2025
Hematoencefāliskā barjera ir ārkārtīgi svarīga smadzeņu homeostāzes nodrošināšanai, taču daudzi jautājumi par tās veidošanos vēl nav pilnībā noskaidroti. Taču jau tagad ir skaidrs, ka hematoencefāliskā barjera ir visdiferencētākā, sarežģītākā un blīvākā histohematiskā barjera. Tās galvenā strukturālā un funkcionālā vienība ir smadzeņu kapilāru endotēlija šūnas.
Smadzeņu vielmaiņa, tāpat kā neviens cits orgāns, ir atkarīga no vielām, kas nonāk kopā ar asinsriti. Daudzi asinsvadi, kas nodrošina nervu sistēmas darbību, izceļas ar to, ka vielu iekļūšanas process caur to sieniņām ir selektīvs. Smadzeņu kapilāru endotēlija šūnas ir savienotas viena ar otru ar nepārtrauktiem ciešiem kontaktiem, tāpēc vielas var iziet tikai caur pašām šūnām, bet ne starp tām. Glia šūnas, kas ir hematoencefāliskā barjeras otrā sastāvdaļa, atrodas blakus kapilāru ārējai virsmai. Smadzeņu kambaru asinsvadu pinumos barjeras anatomisko pamatu veido epitēlija šūnas, kas arī ir cieši saistītas viena ar otru. Pašlaik hematoencefālisko barjeru uzskata nevis par anatomisku un morfoloģisku, bet gan par funkcionālu veidojumu, kas spēj selektīvi iziet un dažos gadījumos piegādāt dažādas molekulas nervu šūnām, izmantojot aktīvus transporta mehānismus. Tādējādi barjera veic regulējošas un aizsargājošas funkcijas.
Smadzenēs ir struktūras, kurās hematoencefāliskā barjera ir novājināta. Tās galvenokārt ir hipotalāms, kā arī vairākas struktūras 3. un 4. kambara apakšā – vistālāk aizmugurējais lauks (area postrema), subforniskie un subkomisurālie orgāni, kā arī čiekurveida ķermenis. Išēmisku un iekaisīgu smadzeņu bojājumu gadījumā tiek traucēta asins-smadzeņu barjeras integritāte.
Hematoencefāliskā barjera tiek uzskatīta par pilnībā izveidojušos, ja šo šūnu īpašības atbilst diviem nosacījumiem. Pirmkārt, šķidrās fāzes endocitozes (pinocitozes) ātrumam tajās jābūt ārkārtīgi zemam. Otrkārt, starp šūnām jāveidojas specifiskiem ciešiem savienojumiem, kuriem raksturīga ļoti augsta elektriskā pretestība. Pia mater kapilāriem tā sasniedz 1000–3000 omi/cm2, bet intraparenhimālajiem smadzeņu kapilāriem — no 2000 līdz 8000 m/cm2. Salīdzinājumam: skeleta muskuļu kapilāru transendoteliālās elektriskās pretestības vidējā vērtība ir tikai 20 omi/cm2.
Lielākajai daļai vielu asins-smadzeņu barjeras caurlaidību lielā mērā nosaka to īpašības, kā arī neironu spēja patstāvīgi sintezēt šīs vielas. Vielas, kas var pārvarēt šo barjeru, pirmkārt, ir skābeklis un oglekļa dioksīds, kā arī dažādi metālu joni, glikoze, neaizvietojamās aminoskābes un taukskābes, kas nepieciešamas normālai smadzeņu darbībai. Glikoze un vitamīni tiek transportēti, izmantojot nesējus. Tajā pašā laikā D- un L-glikozei ir atšķirīgs iekļūšanas ātrums caur barjeru - pirmajai tas ir vairāk nekā 100 reizes lielāks. Glikozei ir liela nozīme gan smadzeņu enerģijas metabolismā, gan vairāku aminoskābju un olbaltumvielu sintēzē.
Galvenais faktors, kas nosaka asins-smadzeņu barjeras darbību, ir nervu šūnu metabolisma līmenis.
Neironu apgāde ar nepieciešamajām vielām notiek ne tikai ar tiem pieplūstošo asins kapilāru palīdzību, bet arī pateicoties mīksto un arahnoidālo membrānu izaugumiem, caur kuriem cirkulē cerebrospinālais šķidrums. Cerebrospinālais šķidrums atrodas galvaskausa dobumā, smadzeņu kambaros un telpās starp smadzeņu membrānām. Cilvēkiem tā tilpums ir aptuveni 100–150 ml. Pateicoties cerebrospinālajam šķidrumam, tiek uzturēts nervu šūnu osmotiskais līdzsvars un izvadīti nervu audiem toksiski vielmaiņas produkti.
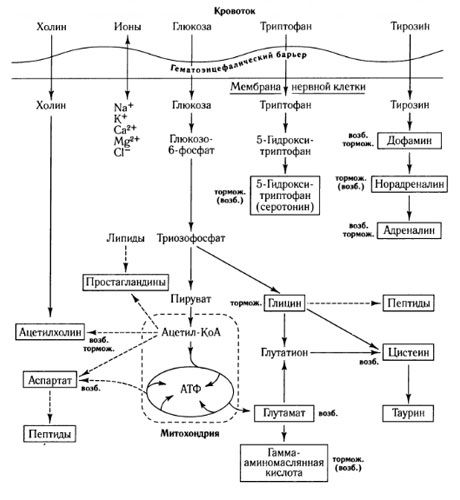
Mediatoru apmaiņas ceļi un hematoencefāliskā barjera loma metabolismā (saskaņā ar: Shepherd, 1987)
Vielu pāreja caur hematoencefālisko barjeru ir atkarīga ne tikai no asinsvadu sienas caurlaidības pret tām (vielas molekulmasa, lādiņš un lipofilitāte), bet arī no aktīvas transporta sistēmas klātbūtnes vai neesamības.
Stereospecifiskais insulīnneatkarīgais glikozes transportētājs (GLUT-1), kas nodrošina šīs vielas pārnesi caur hematoencefālisko barjeru, ir bagātīgi atrodams smadzeņu kapilāru endotēlija šūnās. Šī transportētāja aktivitāte var nodrošināt glikozes piegādi 2–3 reizes lielākā daudzumā nekā smadzenēm nepieciešams normālos apstākļos.
Hematoencefāliskā barjeras transporta sistēmu raksturojums (saskaņā ar: Pardridge, Oldendorf, 1977)
Pārvietojami |
Vēlamais substrāts |
Km, mm |
Vmax |
Heksozes |
Glikoze |
9 |
1600 |
Monokarbonskābes |
Laktāts |
1.9 |
120 |
Neitrālas |
Fenilalanīns |
0,12 |
30 |
Neaizvietojamās |
Lizīns |
0,10 |
6 |
Amīni |
Holīns |
0,22 |
6 |
Purīni |
Adenīns |
0,027 |
1 |
Nukleozīdi |
Adenozīns |
0,018 |
0,7 |
Bērniem ar šī transportētāja darbības traucējumiem ir ievērojams glikozes līmeņa samazinājums cerebrospinālajā šķidrumā un smadzeņu attīstības un darbības traucējumi.
Monokarbonskābes (L-laktāts, acetāts, piruvāts) un ketonvielas tiek transportētas ar atsevišķām stereospecifiskām sistēmām. Lai gan to transporta intensitāte ir zemāka nekā glikozes transporta intensitāte, tās ir svarīgs metabolisma substrāts jaundzimušajiem un bada laikā.
Holīna transportēšanu centrālajā nervu sistēmā arī mediē transportētājs, un to var regulēt acetilholīna sintēzes ātrums nervu sistēmā.
Vitamīnus smadzenes nesintezē, un tie tiek piegādāti no asinīm, izmantojot īpašas transporta sistēmas. Neskatoties uz to, ka šīm sistēmām ir relatīvi zema transporta aktivitāte, normālos apstākļos tās var nodrošināt smadzenēm nepieciešamā vitamīnu daudzuma transportēšanu, taču to deficīts pārtikā var izraisīt neiroloģiskus traucējumus. Daži plazmas proteīni var iekļūt arī asins-smadzeņu barjerā. Viens no to iekļūšanas veidiem ir receptoru mediēta transcitoze. Tādā veidā insulīns, transferīns, vazopresīns un insulīnam līdzīgais augšanas faktors iekļūst barjerā. Smadzeņu kapilāru endotēlija šūnām ir specifiski receptori šiem proteīniem, un tās spēj endocitēt proteīna-receptora kompleksu. Ir svarīgi, ka turpmāko notikumu rezultātā komplekss sadalās, neskartais proteīns var tikt atbrīvots šūnas pretējā pusē, un receptors var atkal integrēties membrānā. Polikatjoniskajiem proteīniem un lektīniem transcitoze arī ir veids, kā iekļūt asins-smadzeņu barjerā, taču tā nav saistīta ar specifisku receptoru darbu.
Daudzi asinīs esošie neirotransmiteri nespēj iekļūt asins-asins barjerā (BBB). Tādējādi dopamīnam nav šīs spējas, savukārt L-DOPA iekļūst BBB, izmantojot neitrālo aminoskābju transporta sistēmu. Turklāt kapilāru šūnās ir enzīmi, kas metabolizē neirotransmiterus (holīnesterāzi, GABA transamināzi, aminopeptidāzes utt.), zāles un toksiskas vielas, kas nodrošina smadzeņu aizsardzību ne tikai no asinīs cirkulējošiem neirotransmiteriem, bet arī no toksīniem.
BBB darbā ir iesaistīti arī nesējproteīni, kas transportē vielas no smadzeņu kapilāru endotēlija šūnām asinīs, novēršot to iekļūšanu smadzenēs, piemēram, b-glikoproteīnu.
Ontoģenēzes laikā dažādu vielu transportēšanas ātrums caur asins-asinsvadu barjeru (BBB) būtiski mainās. Tādējādi b-hidroksibutirāta, triptofāna, adenīna, holīna un glikozes transportēšanas ātrums jaundzimušajiem ir ievērojami lielāks nekā pieaugušajiem. Tas atspoguļo attīstošo smadzeņu relatīvi lielāko enerģijas un makromolekulāro substrātu nepieciešamību.


 [
[