
Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Jauna pieeja bloķē vēža šūnu adaptāciju un divkāršo ķīmijterapijas efektivitāti
Pēdējā pārskatīšana: 27.07.2025
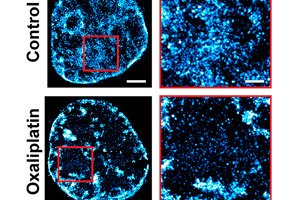
Pilnīgi jaunā vēža ārstēšanas pieejā Nortvesternas universitātes biomedicīnas inženieri dzīvnieku eksperimentā ir divkāršojuši ķīmijterapijas efektivitāti.
Tā vietā, lai tieši uzbruktu vēzim, šī unikālā stratēģija neļauj vēža šūnām attīstīties un kļūt rezistentām pret ārstēšanu, padarot slimību uzņēmīgāku pret esošajām zālēm. Šī pieeja ne tikai praktiski iznīcināja slimību šūnu kultūrās, bet arī ievērojami uzlaboja ķīmijterapijas efektivitāti olnīcu vēža peļu modeļos.
Pētījums tika publicēts žurnālā Proceedings of the National Academy of Sciences.
“Vēža šūnas ir lieliski adaptētāji,” saka Vadims Bekmens no Ziemeļrietumu universitātes, kurš vadīja pētījumu. “Tās var pielāgoties gandrīz jebkam. Vispirms tās iemācās izvairīties no imūnsistēmas. Pēc tam tās iemācās pretoties ķīmijterapijai, imunoterapijai un staru terapijai. Kad tās kļūst rezistentas pret šīm ārstēšanas metodēm, tās dzīvo ilgāk un iegūst jaunas mutācijas. Mēs negribējām tieši iznīcināt vēža šūnas. Mēs gribējām atņemt tām superspēju — iedzimto spēju pielāgoties, mainīties un izvairīties no tām.”
Bekmens ir Saksu ģimenes biomedicīniskās inženierijas un medicīnas profesors Ziemeļrietumu universitātes Makkormika Inženierzinātņu skolā, kur viņš vada Fizikālās genomikas un inženierijas centru. Viņš ir arī Roberta H. Lūrija Visaptverošā vēža centra, Dzīvības procesu ķīmijas institūta un Starptautiskā nanozinātņu institūta loceklis.
Hromatīns ir vēža izdzīvošanas atslēga
Vēzim piemīt daudzas atšķirīgas iezīmes, taču visu pamatā ir viena iezīme: tā nerimstošā spēja izdzīvot. Pat tad, kad imūnsistēma un agresīva medicīniskā ārstēšana uzbrūk audzējam, vēzis var sarukt vai palēnināt tā augšanu, taču tas reti izzūd pilnībā. Lai gan ģenētiskās mutācijas veicina rezistenci, mutācijas notiek pārāk lēni, lai izskaidrotu vēža šūnu straujo reakciju uz stresu.
Virknē pētījumu Bekmena komanda atklāja fundamentālu mehānismu, kas izskaidro šo spēju. Ģenētiskā materiāla, ko sauc par hromatīnu, sarežģītā organizācija nosaka vēža spēju pielāgoties un izdzīvot pat visspēcīgāko zāļu iedarbībā.
Hromatīns, makromolekulu grupa, kas ietver DNS, RNS un olbaltumvielas, nosaka, kuri gēni tiek represēti un kuri tiek ekspresēti. Lai divus metrus DNS, kas veido genomu, ievietotu tikai simtdaļas milimetra attālumā šūnas kodola iekšpusē, hromatīns ir ārkārtīgi sablīvēts.
Apvienojot attēlveidošanu, modelēšanu, sistēmu analīzi un in vivo eksperimentus, Bekmena komanda atklāja, ka šī iepakojuma 3D arhitektūra ne tikai kontrolē, kuri gēni tiek aktivizēti un kā šūnas reaģē uz stresu, bet arī ļauj šūnām fiziski kodēt gēnu transkripcijas modeļu "atmiņu" paša iepakojuma ģeometrijā.
Genoma trīsdimensiju izkārtojums darbojas kā pašmācības sistēma, līdzīga mašīnmācīšanās algoritmam. "Mācoties", šis izkārtojums tiek pastāvīgi reorganizēts tūkstošos nanoskopisku hromatīna iepakošanas domēnu. Katrs domēns uzglabā daļu no šūnas transkripcijas atmiņas, kas nosaka šūnas darbību.
Hromatīna pārprogrammēšana, lai uzlabotu ķīmijterapiju
Jaunajā pētījumā Bekmens un viņa kolēģi izstrādāja skaitļošanas modeli, kas izmanto fizikālus principus, lai analizētu, kā hromatīna iesaiņošana ietekmē vēža šūnas izdzīvošanas iespējamību pēc ķīmijterapijas. Pielietojot modeli dažādiem vēža šūnu veidiem un ķīmijterapijas zāļu klasēm, komanda atklāja, ka tā var precīzi paredzēt šūnu izdzīvošanu — pat pirms ārstēšanas uzsākšanas.
Tā kā hromatīna iepakojums ir kritiski svarīgs vēža šūnu izdzīvošanai, zinātnieki sev jautāja: kas notiktu, ja iepakojuma arhitektūra tiktu mainīta? Tā vietā, lai radītu jaunas zāles, viņi pārbaudīja simtiem esošo zāļu, lai atrastu kandidātus, kas varētu mainīt fizisko vidi šūnu kodolos un ietekmēt hromatīna iepakojumu.
Galu galā komanda izvēlējās celekoksibu, FDA apstiprinātu pretiekaisuma līdzekli, ko jau lieto artrīta un sirds un asinsvadu slimību ārstēšanai un kas kā blakusparādība maina hromatīna iepakojumu.
Eksperimentālie rezultāti
Apvienojot celekoksibu ar standarta ķīmijterapiju, pētnieki novēroja ievērojamu mirušo vēža šūnu skaita pieaugumu.
Olnīcu vēža peles modeļos paklitaksela (izplatītas ķīmijterapijas zāles) un celekoksiba kombinācija samazināja vēža šūnu adaptācijas ātrumu un uzlaboja audzēja augšanas nomākumu, pārspējot paklitaksela monoterapiju.
"Kad mēs lietojām mazu ķīmijterapijas devu, audzēji turpināja augt. Bet, kad ķīmijterapijai pievienojām kandidātu TPR (transkripcijas plastiskuma regulatoru), mēs novērojām daudz nozīmīgāku augšanas inhibīciju. Tas divkāršoja efektivitāti," sacīja Bekmens.
Iespējamās perspektīvas
Šī stratēģija ļautu ārstiem izmantot mazākas ķīmijterapijas devas, tādējādi samazinot smagas blakusparādības. Tas ievērojami uzlabotu pacientu komfortu un viņu pieredzi vēža ārstēšanā.
Bekmens uzskata, ka hromatīna pārprogrammēšana varētu būt galvenais citu sarežģītu slimību, tostarp sirds un asinsvadu un neirodeģeneratīvo slimību, ārstēšanā.
