
Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Identificēts proteīns, kas izraisa ģenētisku iekaisuma slimību
Pēdējā pārskatīšana: 02.07.2025
Pētnieku komanda Dr. Hirotsugu Odas vadībā no CECAD izcilības klastera novecošanas pētījumiem Ķelnes Universitātē ir atklājusi noteikta olbaltumvielu kompleksa lomu dažās imūnsistēmas disregulācijas formās. Šis rezultāts varētu novest pie jaunu terapeitisku pieeju izstrādes, kuru mērķis ir samazināt autoinflāciju un "atjaunot" imūnsistēmu pacientiem, kuri cieš no šī olbaltumvielu kompleksa ģenētiskas disfunkcijas.
Pētījums "Bialēļu cilvēka SHARPIN funkcijas zudums izraisa autoiekaisumu un imūndeficītu" tika publicēts žurnālā Nature Immunology.
Lineārais ubikvitīna montāžas komplekss (LUBAC), kas sastāv no proteīniem HOIP, HOIL-1 un SHARPIN, jau sen ir atzīts par savu kritisko lomu imūnās homeostāzes uzturēšanā. Iepriekšējie pētījumi ar pelēm ir parādījuši SHARPIN zuduma nopietnas sekas, kas izraisa smagu dermatītu pārmērīgas ādas šūnu nāves dēļ. Tomēr konkrētās SHARPIN deficīta sekas cilvēku veselībai joprojām nav skaidras.
Pētnieku komanda pirmo reizi ziņoja par diviem cilvēkiem ar SHARPIN deficītu, kuriem ir autoinflācijas un imūndeficīta simptomi, bet negaidīti nav dermatoloģisku problēmu, kā tas bija pelēm.
Veicot turpmāku izmeklēšanu, tika atklāts, ka šiem indivīdiem ir traucēta kanoniskā NF-κB atbilde, kas ir svarīgs imūnās atbildes ceļš. Viņiem bija arī paaugstināta jutība pret šūnu nāvi, ko izraisa audzēja nekrozes faktora (TNF) superģimenes locekļi. Viena pacienta ar SHARPIN deficītu ārstēšana ar anti-TNF terapiju, kas specifiski inhibē TNF izraisītu šūnu nāvi, izraisīja pilnīgu autoinflācijas izzušanu šūnu līmenī un klīniskajā ainā.
Pētījums liecina, ka pārmērīga un nekontrolēta šūnu nāve spēlē kritisku lomu ģenētiskās cilvēka iekaisuma slimībās. Odas komanda pievienoja SHARPIN deficītu kā jaunu locekli ģenētisko cilvēka iekaisuma slimību grupā, ko viņi ierosina saukt par "iedzimtām šūnu nāves kļūdām".
Aizsardzība pret imūnsistēmas disregulāciju Pētījums tika uzsākts Dr. Dena Kastnera laboratorijā Nacionālajos veselības institūtos (NIH) Amerikas Savienotajās Valstīs. Zinātniekiem tur bija iespēja novērot vienu pacientu, kuram bērnībā bija sākušās neizskaidrojamas drudža, artrīta, kolīta un imūndeficīta epizodes.
Pēc informētas piekrišanas saņemšanas viņi veica pacienta un viņa ģimenes locekļu eksoma sekvencēšanu un atklāja, ka pacientam bija postošs ģenētiskais variants SHARPIN gēnā, kas noveda pie nenosakāma SHARPIN proteīna līmeņa. Viņi arī atklāja, ka pacienta šūnām bija paaugstināta tieksme iet bojā gan kultivētās šūnās, gan pacienta biopsijās.
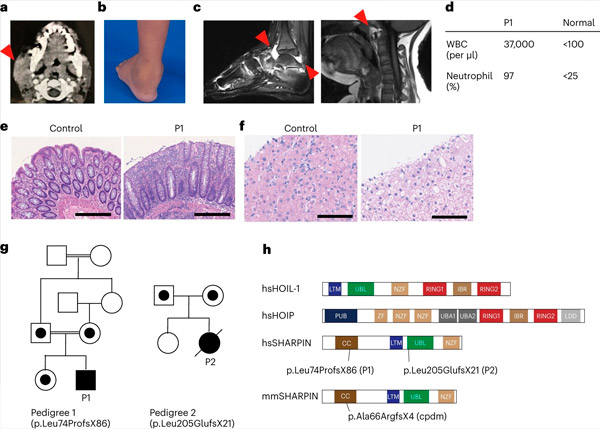
ŠARPĪNA deficīts cilvēkiem izraisa autoiekaisumu un aknu glikogenozi. Avots: Nature Immunology (2024). DOI: 10.1038/s41590-024-01817-w
Komanda arī atklāja, ka limfoīdo germinālo centru – specializētu mikrostruktūru adenoīdos, kas ir kritiski svarīgas mūsu imūnsistēmas B šūnu nobriešanai un līdz ar to antivielu ražošanai – attīstība bija ievērojami samazināta palielinātas B šūnu nāves dēļ. Šie atklājumi izskaidro pacientu imūndeficītu un izceļ LUBAC svarīgo lomu imūnās homeostāzes uzturēšanā cilvēkiem.
"Mūsu pētījums uzsver LUBAC kritisko nozīmi aizsardzībā pret imūnsistēmas disregulāciju. Noskaidrojot LUBAC deficīta pamatā esošos molekulāros mehānismus, mēs paveram ceļu jaunām terapeitiskām stratēģijām, kuru mērķis ir atjaunot imūnsistēmas homeostāzi," sacīja Oda, pētījuma vadošais autors.
Viņš piebilda: "Viens no pacientiem ar SHARPIN deficītu jau gadiem ilgi bija piesaistīts ratiņkrēslam, pirms mēs viņu pirmo reizi redzējām. Viņa potītes bija iekaisušas, un staigāt bija pārāk sāpīgi. Ģenētiskā diagnoze ļāva mums noteikt pareizo molekulāro ceļu, kas ir viņa slimību pamatā."
Kopš pacientam sākās anti-TNF terapija, viņam gandrīz septiņus gadus nav bijuši simptomi. “Kā klīnicistam un zinātniekam man ir prieks par iespēju ar mūsu pētījumu pozitīvi ietekmēt viena pacienta dzīvi,” rezumēja Oda.
