
Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
ARID1A gēna mutācija padara audzējus jutīgus pret imūnterapiju
Pēdējā pārskatīšana: 02.07.2025

Imunoterapija pēdējos gados ir revolucionizējusi vēža ārstēšanu. Tā vietā, lai tieši iedarbotos uz audzējiem, imunoterapija virza pacientu imūnsistēmu efektīvāk uzbrukt audzējiem. Tas ir īpaši efektīvi dažu grūti ārstējamu vēža veidu gadījumā. Tomēr mazāk nekā puse no visiem vēža pacientiem reaģē uz pašreizējām imunoterapijām, radot steidzamu nepieciešamību identificēt biomarķierus, kas var paredzēt, kuriem pacientiem ir vislielākā iespēja gūt labumu no ārstēšanas.
Nesen zinātnieki ir pamanījuši, ka pacientiem, kuru audzējiem ir mutācija ARID1A gēnā, ir lielāka iespēja pozitīvi reaģēt uz imūnās kontrolpunktu blokādi — imunoterapijas veidu, kas darbojas, uzturot aktivizētas pret vēzi apkarojošas imūnās šūnas.
Tā kā ARID1A gēna mutācija ir sastopama daudzos vēža veidos, tostarp endometrija, olnīcu, kolorektālā, kuņģa, aknu un aizkuņģa dziedzera vēža gadījumos, Salk institūta pētnieki domāja, kā tā varētu veicināt ārstēšanas jutīgumu un kā klīnicisti varētu izmantot šo informāciju, lai personalizētu vēža ārstēšanu katram pacientam.
Viņu jaunais pētījums, kas publicēts žurnālā "Cell", liecina, ka ARID1A mutācija padara audzējus jutīgus pret imunoterapiju, piesaistot audzējam pretvēža imūnās šūnas, izmantojot pretvīrusu līdzekļiem līdzīgu imūnreakciju.
Pētnieki norāda, ka šo mutāciju un pretvīrusu imūnreakciju varētu izmantot kā biomarķieri, lai labāk atlasītu pacientus specifiskām imunoterapijām, piemēram, imūnās kontrolpunktu blokādei. Šie atklājumi arī veicina tādu zāļu izstrādi, kas vērstas pret ARID1A un saistītajiem proteīniem, lai padarītu citus audzējus jutīgākus pret imunoterapiju.
"Tas varētu patiešām mainīt vēža ārstēšanas rezultātus pacientiem," sacīja asociētā profesore Diāna Hārgrīvsa, pētījuma vecākā autore. "Pacientiem ar ARID1A mutāciju jau ir imūnreakcija, tāpēc viss, kas mums jādara, ir pastiprināt šo reakciju ar imūno kontrolpunktu blokādi, lai palīdzētu viņiem iznīcināt audzējus no iekšpuses."
Lai gan bija zināms, ka cilvēki ar ARID1A mutācijām labi reaģēja uz imūno kontrolpunktu blokādi, precīza saistība starp abiem joprojām nebija skaidra. Lai noskaidrotu mehānismu, Salk institūta zinātnieki izmantoja melanomas un kolorektālā vēža peļu modeļus ar gan ARID1A mutāciju, gan funkcionējošu ARID1A.
Avots: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Komanda novēroja spēcīgu imūnreakciju visos modeļos ar ARID1A mutāciju, bet ne tajos, kuros ARID1A bija funkcionāls, kas apstiprina ideju, ka ARID1A mutācija patiešām izraisa šo reakciju. Bet kā tas darbojas molekulārā līmenī?
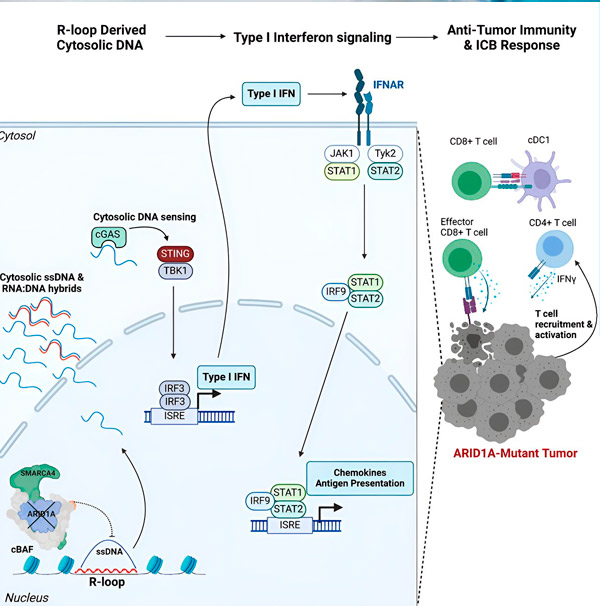
"Mēs atklājām, ka ARID1A spēlē svarīgu lomu kodolā, uzturot pareizu DNS organizāciju," saka Metjū Maksvels, pētījuma pirmais autors un Hargreaves laboratorijas doktorants. "Bez funkcionējoša ARID1A brīvā DNS var tikt izgriezta un atbrīvota citozolā, aktivizējot vēlamo pretvīrusu imūnreakciju, ko var pastiprināt, bloķējot imūnās kontroles punktus."
ARID1A gēns kodē olbaltumvielu, kas palīdz regulēt mūsu DNS formu un uzturēt genoma stabilitāti. Kad ARID1A mutē, tas vēža šūnās iedarbina Rūba Goldberga mutācijai līdzīgu notikumu ķēdi.
Pirmkārt, funkcionējoša ARID1A trūkums izraisa DNS izdalīšanos citozolā. Pēc tam citozola DNS aktivizē pretvīrusu trauksmes sistēmu — cGAS-STING signālceļu, jo mūsu šūnas ir pielāgojušās atzīmēt jebkuru citozolā esošo DNS kā svešu, lai aizsargātu pret vīrusu infekcijām. Galu galā cGAS-STING signālceļš iesaista imūnsistēmu, lai piesaistītu T šūnas audzējam un aktivizētu tās par specializētām vēža iznīcinātājšūnām T šūnām.
Katrā solī, atkarībā no iepriekšējā, šī notikumu ķēde — ARID1A mutācija, DNS izkļūšana, cGAS-STING trauksme, T šūnu pieplūdums — noved pie vēža apkarošanas T šūnu skaita palielināšanās audzējā. Pēc tam imūnsistēmas kontrolpunktu blokādi var izmantot, lai nodrošinātu, ka šīs T šūnas paliek aktivizētas, uzlabojot to spēju uzveikt vēzi.
"Mūsu atklājumi sniedz jaunu molekulāru mehānismu, ar kuru ARID1A mutācija var veicināt pretvēža imūnreakciju," saka Hārgrīvss. "Aizraujoši šajos atklājumos ir to translācijas potenciāls. Mēs varam izmantot ARID1A mutācijas, lai atlasītu pacientus imūnās kontrolpunktu blokādei, un tagad mēs redzam mehānismu, ar kuru zāles, kas inhibē ARID1A vai tā olbaltumvielu kompleksu, varētu izmantot, lai vēl vairāk uzlabotu imunoterapiju citiem pacientiem."
Aprakstot mehānismu, ar kuru imūnās kontrolpunktu blokāde ir efektīvāka ARID1A mutācijas skartos vēža gadījumos, pētnieki sniedz klīnicistiem pamatojumu šīs imunoterapijas prioritātei pacientiem ar ARID1A mutāciju. Šie atklājumi ir svarīgs solis ceļā uz vēža ārstēšanas personalizēšanu un iedvesmo jaunu terapiju izstrādi, kas vērstas pret ARID1A un tā olbaltumvielu kompleksu.
Turpmāk Salk institūta komanda cer, ka viņu atklājumi uzlabos ārstēšanas rezultātus pacientiem ar dažādiem vēža veidiem, kas saistīti ar ARID1A mutācijām, un plāno izpētīt šo klīnisko tulkojumu sadarbībā ar Kalifornijas Universitāti Sandjego.
