
Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Smagas sepses un septiskā šoka ārstēšana
Raksta medicīnas eksperts
Pēdējā pārskatīšana: 04.07.2025
Efektīva sepses ārstēšana ir iespējama tikai ar pilnīgu infekcijas vietas ķirurģisku sanāciju un atbilstošu pretmikrobu terapiju. Nepietiekama sākotnējā pretmikrobu terapija ir nāves riska faktors pacientiem ar sepsi. Pacienta dzīvības saglabāšana, orgānu disfunkciju novēršana un likvidēšana ir iespējama tikai ar mērķtiecīgu intensīvo aprūpi.
Tās galvenais mērķis ir optimizēt O2 transportu paaugstināta O2 patēriņa apstākļos, kas ir raksturīgi smagai sepsei un septiskam šokam. Šī ārstēšana tiek īstenota, izmantojot hemodinamikas un elpošanas atbalstu.
Hemodinamiskais atbalsts
Infūzijas terapija
Infūzijas terapija ir viens no sākotnējiem pasākumiem hemodinamikas un, galvenokārt, sirds izsviedes uzturēšanai. Tās galvenie uzdevumi pacientiem ar sepsi ir:
- atbilstošas audu perfūzijas atjaunošana,
- homeostāzes traucējumu korekcija,
- šūnu metabolisma normalizēšana,
- septiskās kaskādes mediatoru un toksisko metabolītu koncentrācijas samazināšanās.
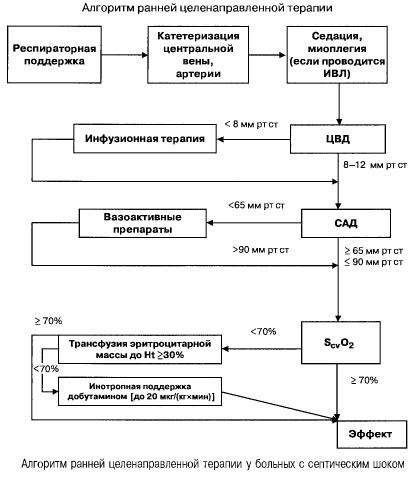
Sepses gadījumā ar vairāku orgānu mazspēju un septisku šoku viņi cenšas ātri (pirmo 6 stundu laikā) sasniegt šādas svarīgu rādītāju vērtības:
- hematokrīts >30%,
- diurēze 0,5 ml/(kg/h),
- asins piesātinājums augšējā dobajā vēnā vai labajā priekškambarī >70%,
- vidējais asinsspiediens > 65 mm Hg,
- Sirds un asinsvadu sistēma (CVS) 8–12 mm Hg
Šo vērtību saglabāšana norādītajā līmenī uzlabo pacientu izdzīvošanu (B pierādījumu kategorija). Hemodinamiskā monitorēšana, izmantojot Swan-Ganz katetru un PICCO tehnoloģiju (transpulmonāla termodilūcija un pulsa viļņu analīze), paplašina hemodinamiskās terapijas efektivitātes uzraudzības un novērtēšanas iespējas, taču nav pierādījumu, ka tās uzlabo izdzīvošanu.
Optimālā priekšslodzes vērtība tiek izvēlēta individuāli, jo jāņem vērā endotēlija bojājuma pakāpe un limfodrenāžas stāvoklis plaušās, kambaru diastoliskā funkcija un intratorakālā spiediena izmaiņas. Infūzijas terapijas tilpums tiek izvēlēts tā, lai PCWP nepārsniegtu plazmas COP (OL profilakse) un nepalielinātos CO. Papildus tiek ņemti vērā plaušu gāzu apmaiņas funkciju raksturojošie parametri (paO2 un paO2 / FiO2 ) un radiogrāfiskā attēla izmaiņas.
Infūzijas terapijai kā daļai no mērķtiecīgas sepses un septiskā šoka ārstēšanas tiek izmantoti kristaloīdie un koloidālie šķīdumi ar praktiski identiskiem rezultātiem.
Visiem infūzijas līdzekļiem ir gan priekšrocības, gan trūkumi. Ņemot vērā eksperimentālo un klīnisko pētījumu rezultātus, mūsdienās nav pamata dot priekšroku kādam konkrētam veidam.
- Piemēram, venozās atgriešanās un priekšslodzes līmeņa adekvātai korekcijai nepieciešams ievadīt kristaloīdu tilpumu, kas ir 2–4 reizes lielāks nekā koloīdu tilpums, kas ir saistīts ar šķīduma sadalījuma īpatnībām organismā. Turklāt kristaloīdu infūzija ir saistīta ar lielāku audu tūskas risku, un to hemodinamiskā iedarbība ir īsāka nekā koloīdiem. Tajā pašā laikā kristaloīdi ir lētāki, neietekmē koagulācijas potenciālu un neizraisa anafilaktoīdas reakcijas. Pamatojoties uz iepriekš minēto, infūzijas programmas kvalitatīvais sastāvs tiek noteikts atkarībā no pacienta īpašībām, ņemot vērā hipovolēmijas pakāpi, DIC sindroma fāzi, perifērās tūskas klātbūtni un albumīna koncentrāciju asins serumā, akūtas plaušu traumas smagumu.
- Smaga BCC deficīta gadījumos ir indicēti plazmas aizstājēji (dekstrāni, želatīna preparāti, hidroksietilciete). Hidroksietilcietēm ar aizvietošanas pakāpi 200/0,5, 130/0,4 un 130/0,42 ir potenciāla priekšrocība salīdzinājumā ar dekstrāniem, jo tām ir mazāks membrānas izslīdēšanas risks un klīniski nozīmīgas ietekmes uz hemostāzi neesamība.
- Albumīna ievadīšana kritiskos apstākļos var palielināt nāves risku. KOP palielināšanās tā infūzijas laikā ir pārejoša, un pēc tam, palielinoties kapilāru caurlaidībai ("kapilāru noplūdes" sindroms), notiek turpmāka albumīna ekstravazācija. Iespējams, ka albumīna pārliešana būs noderīga tikai tad, ja tā koncentrācija serumā ir mazāka par 20 g/l un nav pazīmju par "noplūdi" intersticijā.
- Krioplazmas lietošana ir indicēta patēriņa koagulopātijas un samazināta asins recēšanas potenciāla gadījumā.
- Plaši izplatīta donoru sarkano asinsķermenīšu masas lietošana jāierobežo, jo pastāv augsts dažādu komplikāciju (APL, anafilaktiskas reakcijas utt.) attīstības risks. Pēc vairuma ekspertu domām, minimālā hemoglobīna koncentrācija pacientiem ar smagu sepsi ir 90–100 g/l.
Hipotensijas korekcija
Zems perfūzijas spiediens prasa nekavējoties aktivizēt zāles, kas palielina asinsvadu tonusu un/vai sirds inotropisko funkciju. Dopamīns vai norepinefrīns ir pirmās izvēles zāles hipotensijas korekcijai pacientiem ar septisku šoku.
Dopamīns (dopmīns) devā <10 mkg/(kg x min) paaugstina asinsspiedienu, galvenokārt palielinot CO, un minimāli ietekmē sistēmisko asinsvadu pretestību. Lielās devās dominē tā α-adrenerģiskā iedarbība, kas izraisa arteriālu vazokonstrikciju, un devā <5 mkg/(kg x min) dopamīns stimulē nieru, mezentērija un koronāro asinsvadu dopamīnerģiskos receptorus, izraisot vazodilatāciju, palielinātu glomerulāro filtrāciju un Na+ izdalīšanos.
Norepinefrīns paaugstina vidējo arteriālo spiedienu un palielina glomerulārās filtrācijas ātrumu. Sistēmiskās hemodinamikas optimizācija tā iedarbībā noved pie nieru darbības uzlabošanās, neizmantojot mazas dopamīna devas. Pēdējo gadu pētījumi liecina, ka tā atsevišķa lietošana, salīdzinot ar kombināciju ar lielām dopamīna devām, noved pie statistiski nozīmīgas mirstības samazināšanās.
Adrenalīns ir adrenerģiskas zāles ar visizteiktākajām hemodinamiskajām blakusparādībām. Tam ir no devas atkarīga ietekme uz sirdsdarbības ātrumu, vidējo arteriālo spiedienu, sirds izsviedi, kreisā kambara funkciju, kā arī O2 piegādi un patēriņu . Tomēr vienlaikus rodas tahiaritmijas, orgānu asinsrites pasliktināšanās un hiperlaktatēmija. Tādēļ adrenalīna lietošana ir ierobežota ar gadījumiem, kad pacients pilnībā nereaģē uz citiem kateholamīniem.
Dobutamīns ir izvēles zāles CO un O2 piegādes un patēriņa palielināšanai normālas vai paaugstinātas priekšslodzes gadījumā. Tā kā tas galvenokārt iedarbojas uz beta1 adrenerģiskajiem receptoriem, tas ir efektīvāks par dopamīnu šo parametru paaugstināšanā.
Eksperimentāli pētījumi ir parādījuši, ka kateholamīni papildus asinsrites atbalstam var regulēt sistēmiskā iekaisuma gaitu, ietekmējot galveno mediatoru sintēzi ar attālinātu efektu. Adrenalīna, dopamīna, noradrenalīna un dobutamīna ietekmē aktivētie makrofāgi samazina TNF-a sintēzi un sekrēciju.
Adrenerģisko līdzekļu izvēle tiek veikta saskaņā ar šādu algoritmu:
- sirds indekss 3,5–4 l/(min x m² ), SvO² > 70% — dopamīns vai norepinefrīns,
- Sirds indekss <3,5 l/(min x m2 ), SvO2 <70% - dobutamīns (ja sistoliskais asinsspiediens <70 mm Hg - kopā ar norepinefrīnu vai dopamīnu).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
Elpošanas atbalsts
Plaušas ir vieni no pirmajiem mērķa orgāniem, kas iesaistīti patoloģiskajā procesā sepses gadījumā. Akūta elpošanas mazspēja ir viena no galvenajām vairāku orgānu disfunkcijas sastāvdaļām. Tās klīniskās un laboratoriskās izpausmes sepses gadījumā atbilst ALI, un, patoloģiskajam procesam progresējot, - ARDS. Mehāniskās ventilācijas indikācijas smagas sepses gadījumā tiek noteiktas atkarībā no parenhimatozās elpošanas mazspējas (ARF vai ARDS) smaguma pakāpes. Tās kritērijs ir elpošanas indekss:
- <200 — ir indicēta trahejas intubācija un elpošanas atbalsts,
- >200 — rādījumi tiek noteikti individuāli.
Ja pacients spontānas elpošanas laikā ar skābekļa atbalstu ir pie samaņas, nav lielu elpošanas darba izdevumu un izteiktas tahikardijas (HR <120 minūtē), venozās atgriešanās SO2 normālā vērtība ir > 90%, tad ir iespējams atturēties no pārnešanas uz mākslīgo plaušu ventilāciju. Tomēr ir nepieciešams rūpīgi uzraudzīt pacienta stāvokli. Optimālā SO2 vērtība ir aptuveni 90%. To var uzturēt ar dažādām gāzes piegādes metodēm (sejas maskas, deguna katetri) netoksiskās koncentrācijās (FiO2 < 0,6). Neinvazīva mākslīgā plaušu ventilācija ir kontrindicēta sepses gadījumā (B pierādījumu kategorija).
Jāizvairās no liela apjoma mehāniskās ventilācijas (MVV) režīmiem (VO2 = 12 ml/kg), jo šādos gadījumos palielinās citokīnu sekrēcija plaušās, kas noved pie MOF saasināšanās. Ir jāievēro drošas mehāniskās ventilācijas koncepcija, kas ir iespējama, ja ir izpildīti šādi nosacījumi (A pierādījumu kategorija):
- DO <10 ml/kg,
- neapgriezta ieelpas un izelpas attiecība,
- maksimālais elpceļu spiediens <35 cm H2O,
- FiO2 < 0,6.
Elpošanas cikla parametru izvēle tiek veikta, līdz tiek panākta atbilstoša mehāniskā ventilācija, tās kritēriji ir paO2 > 60 mm Hg, SpO2 > 88–93%, pvO2 35–45 mm Hg, SvO2 > 55%.
Viena no efektīvām gāzu apmaiņas optimizācijas metodēm ir mākslīgās ventilācijas veikšana guļus stāvoklī (Prone Positioning) (B pierādījumu kategorija). Šī pozīcija ir efektīva pacientiem vissmagākajā stāvoklī, lai gan tās ietekme uz mirstības samazināšanu ilgtermiņā ir statistiski nenozīmīga.
Uztura atbalsts
Mākslīgā uztura nodrošināšana ir svarīgs ārstēšanas elements, viens no obligātajiem pasākumiem, jo vairāku orgānu mazspējas sindroma attīstība sepses gadījumā parasti ir saistīta ar hipermetabolisma izpausmēm. Šādā situācijā enerģijas vajadzības tiek apmierinātas, iznīcinot savas šūnu struktūras (autokanibālismu), kas saasina orgānu disfunkciju un palielina endotoksikozi.
Uztura atbalsts tiek uzskatīts par smagas izsīkuma (olbaltumvielu-enerģijas deficīta) novēršanas metodi uz izteikta kata- un metabolisma palielināšanās fona. Enterālās uztura iekļaušana intensīvās terapijas kompleksā novērš zarnu mikrofloras kustību, disbakteriozi, palielina enterocītu funkcionālo aktivitāti un zarnu gļotādas aizsargājošās īpašības. Šie faktori samazina endotoksikozes pakāpi un sekundāru infekcijas komplikāciju risku.
Uzturvērtības atbalsta aprēķins:
- enerģētiskā vērtība - 25–35 kcal/(ķermeņa svara kg x dienā),
- olbaltumvielu daudzums - 1,3–2,0 g/(kg ķermeņa svara x dienā),
- ogļhidrātu (glikozes) daudzums — mazāk nekā 6 g/kg/dienā,
- tauku daudzums — 0,5–1 g/kg/dienā,
- glutamīna dipeptīdi 0,3–0,4 g/kg/dienā,
- vitamīni - standarta dienas komplekts + K vitamīns (10 mg/dienā) + B1 un B6 vitamīni (100 mg/dienā) + A, C, E vitamīni,
- mikroelementi - standarta dienas deva + Zn (15-20 mg/dienā + 10 mg/dienā, ja ir šķidra vēdera izeja),
- elektrolīti - Na+, K+, Ca2+ atbilstoši līdzsvara aprēķiniem un koncentrācijai plazmā.
Agrīna uztura atbalsta uzsākšana (24–36 h) ir efektīvāka nekā intensīvās terapijas 3.–4. dienā (B pierādījumu kategorija), īpaši enterālās barošanas ar zondi gadījumā.
Smagas sepses gadījumā enterālai vai parenterālai barošanai nav priekšrocību; orgānu disfunkcijas ilgums un elpošanas un inotropā atbalsta ilgums ir vienāds, un mirstības rādītāji ir vienādi. Ņemot vērā iepriekš minēto, agrīna enterāla barošana ir lētāka alternatīva parenterālai barošanai. Ar uztura šķiedrvielām (prebiotikām) bagātinātu maisījumu lietošana barošanai caur zondi ievērojami samazina caurejas biežumu pacientiem ar smagu sepsi.
Efektīvai olbaltumvielu sintēzei organismā ir svarīgi uzturēt vielmaiņas attiecību "kopējais slāpeklis, g - neolbaltumvielu kalorijas, kcal" = 1-(110-130). Maksimālā ogļhidrātu deva ir 6 g/(kg ķermeņa masas dienā), jo lielu devu ievadīšana apdraud hiperglikēmiju un katabolisma aktivāciju skeleta muskuļos. Tauku emulsijas ieteicams ievadīt visu diennakti.
Kontrindikācijas uztura atbalstam:
- dekompensēta metaboliskā acidoze,
- individuāla nepanesība pret uztura bagātinātājiem,
- smaga neārstēta hipovolēmija,
- refraktārs šoks — dopamīna deva >15 mcg/(kg x min) un sistoliskais asinsspiediens <90 mm Hg,
- smaga, neārstējama arteriāla hipoksēmija.
Glikēmijas kontrole
Svarīgs smagas sepses kompleksās ārstēšanas aspekts ir pastāvīga glikozes koncentrācijas asins plazmā kontrole un insulīna terapija. Augsta glikēmija un nepieciešamība to koriģēt ir nelabvēlīga iznākuma faktori sepses gadījumā. Ņemot vērā iepriekš minētos apstākļus, pacientiem tiek uzturēta normoglikēmija (4,5–6,1 mmol/l), kurai, glikozes koncentrācijai palielinoties virs pieļaujamajām vērtībām, tiek veikta insulīna infūzija (0,5–1 U/h). Atkarībā no klīniskās situācijas glikozes koncentrācija tiek kontrolēta ik pēc 1–4 stundām. Ieviešot šo algoritmu, tika konstatēts statistiski nozīmīgs pacientu izdzīvošanas pieaugums.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
Glikokortikoīdi
Mūsdienu pētījumu rezultāti par glikokortikoīdu lietošanas efektivitāti pacientiem ar septisku šoku ir apkopoti šādos apgalvojumos:
- Nav ieteicams lietot hormonus lielās devās [metilprednizolons 30–120 mg/(kg x dienā) vienu reizi vai 9 dienas, deksametazons 2 mg/(kg x dienā) 2 dienas, betametazons 1 mg/(kg x dienā) 3 dienas] — paaugstināts hospitālo infekciju risks, nav ietekmes uz izdzīvošanu,
- Hidrokortizona lietošana 240–300 mg devā dienā 5–7 dienas paātrina hemodinamisko parametru stabilizāciju, ļauj pārtraukt asinsvadu atbalstu un uzlabo izdzīvošanu pacientiem ar vienlaicīgu relatīvu virsnieru mazspēju (B pierādījumu kategorija).
Ir jāatsakās no haotiskās empīriskās prednizolona un deksametazona izrakstīšanas - nav pamata ekstrapolēt uz tiem jaunu informāciju. Ja nav laboratorisku pierādījumu par relatīvo virsnieru mazspēju, tiek ievadīts hidrokortizons 300 mg devā dienā (3-6 injekcijās).
- refraktāra šoka gadījumā,
- ja efektīvas hemodinamikas uzturēšanai nepieciešamas lielas vazopresoru devas.
Iespējams, ka sistēmiska iekaisuma apstākļos septiskā šoka gadījumā hidrokortizona efektivitāte ir saistīta ar kodolfaktora kB inhibitora (NF-kB-α) aktivāciju un relatīvas virsnieru mazspējas korekciju. Savukārt transkripcijas kodolfaktora (NF-kB) aktivitātes inhibīcija noved pie inducējamās NO sintetāzes (NO ir visspēcīgākais endogēnais vazodilatators), proinflamatorisko citokīnu, COX un adhēzijas molekulu veidošanās samazināšanās.
Aktivētais proteīns C
Viena no raksturīgajām sepses izpausmēm ir sistēmiskās koagulācijas traucējumi (koagulācijas kaskādes aktivācija un fibrinolīzes inhibīcija), kas galu galā noved pie hipoperfūzijas un orgānu disfunkcijas. Aktivētā C proteīna ietekme uz iekaisuma sistēmu tiek realizēta vairākos veidos:
- selektīna piesaistes samazināšana leikocītiem, kas aizsargā endotēliju no bojājumiem, kam ir galvenā loma sistēmiska iekaisuma attīstībā,
- samazināta citokīnu izdalīšanās no monocītiem,
- bloķējot TNF-α izdalīšanos no leikocītiem,
- trombīna ražošanas inhibīcija (tas pastiprina iekaisuma reakciju).
Antikoagulanta, profibrinolītiska un pretiekaisuma iedarbība
- Aktivētais C proteīns ir saistīts ar
- Va un VIIIa faktoru degradācija - trombu veidošanās nomākšana,
- plazminogēna aktivatora inhibitora nomākšana - fibrinolīzes aktivācija,
- tieša pretiekaisuma iedarbība uz endotēlija šūnām un neitrofiliem,
- endotēlija aizsardzība pret apoptozi
Aktivētā proteīna C [alfa drotrekogīna (aktivētā)] ievadīšana 24 mcg/(kg h) devā 96 h garumā samazina nāves risku par 19,4%. Lietošanas indikācijas: sepse ar akūtu MOF un augstu nāves risku (APACHE II > 25 punkti, 2 vai vairāku orgānu disfunkcija, B pierādījumu kategorija).
Aktivētais C proteīns nesamazina mirstību bērniem, pacientiem ar viena orgāna disfunkciju, APACHE II < 25 punktiem, pacientiem ar neķirurģisku sepsi.
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
Imūnglobulīni
Imūnglobulīnu (IgG un IgG+IgM) intravenozas ievadīšanas lietderība ir saistīta ar to spēju ierobežot proinflamatorisko citokīnu pārmērīgo darbību, palielināt endotoksīnu un stafilokoku superantigēnu klīrensu, novērst anerģiju un pastiprināt ß-laktāma antibiotiku iedarbību. To lietošana smagas sepses un septiska šoka ārstēšanā ir vienīgā imūnkorekcijas metode, kas palielina izdzīvošanu. Vislabākais efekts tika reģistrēts, lietojot IgG un IgM kombināciju [RR = 0,48 (0,35–0,75), pierādījumu kategorija A]. Standarta dozēšanas režīms ir 3–5 ml/(kg x dienā) 3 dienas pēc kārtas. Lietojot imūnglobulīnus, optimālākie rezultāti tika iegūti šoka agrīnā fāzē ("siltais šoks") un pacientiem ar smagu sepsi (APACHE II vērtējums 20–25 punkti).
Dziļo vēnu trombozes profilakse
Apakšējo ekstremitāšu dziļo vēnu trombozes profilakse būtiski ietekmē ārstēšanas rezultātus pacientiem ar sepsi (A pierādījumu kategorija). Šim nolūkam tiek izmantots gan nefrakcionēts, gan mazmolekulārs heparīns (ZMHH). Zemas molekulmasas heparīnu galvenās priekšrocības ir zemāka hemorāģisko komplikāciju sastopamība, vājāka ietekme uz trombocītu funkciju un ilgstoša iedarbība (var ievadīt vienu reizi dienā).
Stresa čūlu veidošanās novēršana kuņģa-zarnu traktā
Šim virzienam ir nozīmīga loma labvēlīgā iznākumā pacientu ar smagu sepsi un septisku šoku ārstēšanā, jo mirstība no asiņošanas no kuņģa-zarnu trakta stresa čūlām ir 64–87%. Bez profilaktiskiem pasākumiem stresa čūlas rodas 52,8% kritiski slimu pacientu. Tomēr protonu sūkņa inhibitoru un histamīna H2 receptoru blokatoru lietošana samazina risku vairāk nekā 2 reizes (pirmā zāļu grupa ir efektīvāka par otro). Galvenais profilakses un ārstēšanas virziens ir pH uzturēšana 3,5–6,0 robežās. Jāuzsver, ka papildus iepriekšminētajām zālēm svarīga loma stresa čūlu veidošanās novēršanā ir enterālajai barošanai.
Ekstrakorporāla asins attīrīšana
Dažādas bioloģiski aktīvas vielas un vielmaiņas produkti, kas iesaistīti ģeneralizēta iekaisuma attīstībā, ir detoksikācijas metožu mērķi, kas ir īpaši svarīgi, ja nav dabiskas hepatorenālās klīrensa vairāku orgānu mazspējas apstākļos. Nieru aizstājterapijas metodes tiek uzskatītas par daudzsološām, jo tās var ietekmēt ne tikai urēmiskus traucējumus pacientiem ar nieru mazspēju, bet arī pozitīvi ietekmēt citas homeostāzes izmaiņas un orgānu disfunkcijas, kas rodas sepses, šoka un vairāku orgānu mazspējas gadījumā.
Līdz šim nav datu, kas apstiprinātu nepieciešamību izmantot ekstrakorporālas asins attīrīšanas metodes kā vienu no galvenajiem sepses un septiskā šoka patogenētiskās terapijas virzieniem. To lietošana ir pamatota vairāku orgānu mazspējas gadījumā ar nieru dominanci.
 [ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
Hemodialīze
Metodes būtība ir zemas molekulmasas vielu (līdz 5x103 Da) difūzija caur puscaurlaidīgu membrānu un liekā šķidruma izvadīšana no organisma pa spiediena gradientu. Hemodialīze tiek plaši izmantota pacientu ārstēšanai gan ar hronisku, gan akūtu nieru mazspēju. Vielu difūzijas ātrums eksponenciāli ir atkarīgs no to molekulmasas. Piemēram, oligopeptīdu izvadīšana notiek lēnāk nekā to sintēze.
Hemofiltrācija
Hemofiltrācija ir efektīva metode vielu ar molekulmasu 5x103 - 5x104 Da izvadīšanai un vienīgais veids, kā no organisma izvadīt lielu bioloģiski aktīvo vielu un metabolītu grupu. Metode ir balstīta uz masas pārneses konvekcijas metodi. Papildus atbilstošai azotēmijas korekcijai hemofiltrācija efektīvi izvada anafilatoksīnus C3a, C5a, proinflamatoriskos citokīnus (TNF-α, IL-1b, 6 un 8), ß2-mikroglobulīnu, mioglobīnu, parathormonu, lizocīmu (molekulmasa - 6000 Da), α-amilāzi (molekulmasa - 36 000-51 000 Da), kreatīna fosfokināzi, sārmaino fosfatāzi, transamināzes un citas vielas. Hemofiltrācijas laikā tiek izvadītas aminoskābes un plazmas olbaltumvielas (ieskaitot imūnglobulīnus un cirkulējošos imūnkompleksus).
Hemodiafiltrācija
Hemodiafiltrācija ir visspēcīgākā asins attīrīšanas metode, apvienojot difūziju un konvekciju (t. i., GD un GF). Papildu ieguldījumu detoksikācijas procesā sniedz patoloģisko vielu sorbcija uz filtra membrānas.
Plazmaferēze
Plazmaferēze (plazmas apmaiņa, plazmas filtrācija) tiek uzskatīta arī par iespējamu metodi ģeneralizēta iekaisuma korekcijai pacientiem ar sepsi un septisku šoku. Optimālā metode tiek uzskatīta par plazmas apmaiņas izmantošanu nepārtrauktā režīmā, noņemot 3-5 plazmas tilpumus un vienlaikus aizstājot to ar svaigi saldētu, albumīna, koloidālo un kristaloīdu šķīdumiem. Ar sijāšanas koeficientu 1 plazmas filtrācija nodrošina labu C-reaktīvā proteīna, haptoglobīna, komplementa fragmenta C3, 1-antitripsīna, IL-6, tromboksāna-B2, granulocītu stimulējošā faktora, TNF izvadīšanu. Sorbentu izmantošana pacienta plazmas attīrīšanai samazina infekcijas risku un samazina procedūras izmaksas, jo nav nepieciešams izmantot svešas olbaltumvielas.
Ilgstoša nātrija selenīta (selenāzes) infūzija 1000 mcg/dienā smagas sepses gadījumā samazina mirstību.
Selēns ir svarīgs mikroelements, kura nozīme ir saistīta ar tā galveno lomu šūnu antioksidantu sistēmās. Selēna līmenis asinīs tiek uzturēts 1,9–3,17 μM/l robežās. Selēna nepieciešamība ir 50–200 μg dienā, un tā ir atkarīga no citu antioksidantu un mikroelementu pieejamības.
Selēns ir spēcīgs antioksidants, glutationa peroksidāzes, fosfolīna glutationa peroksidāzes, citu oksidoreduktāžu un dažu transferāžu sastāvdaļa. Glutationa peroksidāze ir vissvarīgākā saikne endogēnajā antioksidantu sistēmā.
Selēna efektivitāte kritiskos apstākļos ir pētīta pēdējos gados. Šie pētījumi ir parādījuši, ka galvenie selēna darbības mehānismi ir:
- NF-kB hiperaktivācijas nomākšana;
- samazināta komplementa aktivācija;
- tā darbība kā imūnmodulators, antioksidants un pretiekaisuma līdzeklis
- peroksīda izmantošanas saglabāšana;
- endotēlija adhēzijas nomākšana (samazināta ICAM-1, VCAM-2 ekspresija,
- E - selektīns, P - selektīns);
- endotēlija aizsardzība no oksiradikāļiem (izmantojot selenoproteīnu P, kas novērš peroksinitrīta veidošanos no O2 un NO).
Apkopojot iepriekš minēto, mēs varam definēt konkrētus intensīvās terapijas uzdevumus smagas sepses gadījumā:
- Hemodinamiskais atbalsts: CVS 8–12 mm Hg, vidējais asinsspiediens >65 mm Hg, diurēze 0,5 ml/(kg h), hematokrīts >30%, jauktas venozās asins piesātinājums >70%.
- Elpošanas atbalsta maksimālais elpceļu spiediens <35 cm H2O, skābekļa ieelpas frakcija <60%, elpas tilpums <10 ml/kg, neinvertēta ieelpas un izelpas attiecība.
- Glikokortikoīdi - "zemas devas" (hidrokortizons 240-300 mg dienā).
- Aktivētā proteīna C 24 mcg/(kg h) 4 dienas smagas sepses gadījumā (APACHE II >25).
- Imūnkorekcijas aizstājterapija ar pentaglobīnu.
- Apakšējo ekstremitāšu dziļo vēnu trombozes profilakse.
- Kuņģa-zarnu trakta stresa čūlu veidošanās novēršana: protonu sūkņa inhibitoru un H2-histamīna receptoru blokatoru lietošana.
- Aizstājterapija akūtas nieru mazspējas gadījumā.
- Uzturvērtības nodrošinājums: pārtikas enerģētiskā vērtība 25–30 kcal/kg ķermeņa svara x dienā), olbaltumvielas 1,3–2,0 g/(kg ķermeņa svara x dienā), glutamīna dipeptīdi 0,3–0,4 g/(kg x dienā), glikoze – 30–70% no neolbaltumvielu kalorijām, ja glikēmija tiek uzturēta <6,1 mmol/l, tauki – 15–50% no neolbaltumvielu kalorijām.

